2025
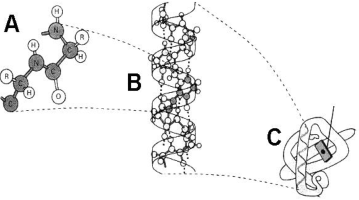
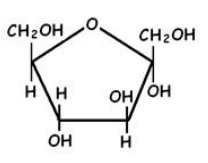
1. 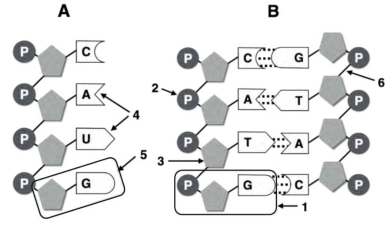 En relación con la imagen: (a) Identifique a qué tipo de macromolécula pertenecen los esquemas A y B. Indique de manera razonada una característica que permita diferenciar entre A y B (0,6). (b) Identifique las moléculas señaladas con los números 1, 2, 3, 4 y 5. ¿Qué representan las líneas punteadas de la macromolécula “B”? ¿Qué tipo de enlace es el señalado como 6? (0,9) (c) Indique la localización de la molécula “B” en la célula procariota y eucariota (0,5).
En relación con la imagen: (a) Identifique a qué tipo de macromolécula pertenecen los esquemas A y B. Indique de manera razonada una característica que permita diferenciar entre A y B (0,6). (b) Identifique las moléculas señaladas con los números 1, 2, 3, 4 y 5. ¿Qué representan las líneas punteadas de la macromolécula “B”? ¿Qué tipo de enlace es el señalado como 6? (0,9) (c) Indique la localización de la molécula “B” en la célula procariota y eucariota (0,5).
a. (A) es una molécula de ARN y (B) es una molécula de ADN; se diferencian porque en todas las células el segundo es siempre bicatenario y el primero es monocatenario. Además el primero presenta ribosa donde el segundo tiene desoxirribosa y el primero tiene uracilo donde el segundo presenta timina.
b. (1) es el nucleótido desoxiguanosín-monofosfato; (2) es fosfato orgánico; (3) es 2-desoxirribosa; (4) son las bases nitrogenadas orgánicas adenina y uracilo; (5) es el nucleósido guanosina; puentes de hidrógeno; (6) enlace nucleotídico, de tipo fosfodiéster.
c. Procariótica: región del citoplasma deominada nucleoide, formando un único cromosoma. Eucariótica: en el núcleo, formando la cromatina, en las mitocondrias y en los cloroplastos.
2. Respecto a las moléculas biológicas: (a) Indique qué tipo de biomolécula es la celulosa, su función y localización. ¿Cómo se llama y de qué tipo es el enlace que se produce entre los monómeros constituyentes de la celulosa? (0,7) (b) Indique las unidades monoméricas que componen el almidón, los tipos de polímeros que lo constituyen y los tipos de enlace que se forman. ¿En qué tipo de células se encuentra esta molécula y cuál es su función? (1,3)
a. Es un glúcido, en concreto es un polisacárido. Tiene función estructural: constituye una estructura biológica estable, en concreto es el componente principal de la pared celular de las plantas y las algas. Es el enlace O-glucosídico, de tipo covalente.
b. Es la α-D-glucopiranosa. Amilosa: α-D-glucosas unidas mediante enlaces 1→4 en cadenas sin ramificar y amilopectina: α-D-glucosas unidas mediante enlaces 1→4 en cadenas con ramificaciones en 1→6. Se encuentra en células de animales (en humanos en hígado músculos) y en hongos donde funciona como reserva de energía: su movilización por glucogenolisis dará lugar a moléculas de glucosa listas para rendir ATP mediante la respiración celular.
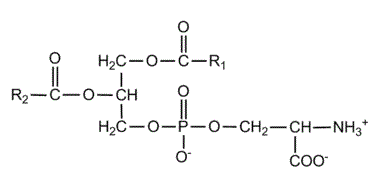
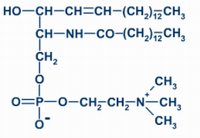
3. Las siguientes estructuras (1) y (2) son compuestos lipídicos: (a) ¿A qué grupo de lípidos corresponde cada una? (0,6) (b) Identificar los componentes de las moléculas (1) y (2) y cuáles son los dos enlaces marcados con las flechas (1,0). (c) Indicar las principales funciones de las moléculas (1) y (2) (0,4). 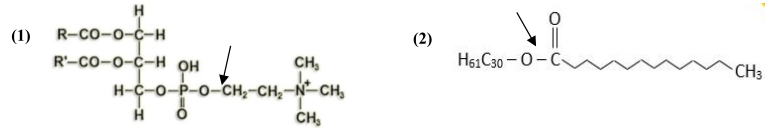
a. (1) es un fosfoglicérido (la fosfatidil-colina o lecitina) y (2) es una cera.
b. (1): 2 ácidos grasos unidos a una molécula de glicerol, unida a una molécula de fosfato, unida al aminoalcohol colina. (2) un alcohol monovalente y un ácido graso. En (1) enlace éster-fosfórico; en (2) enlace éster.
c. (1): es el componente fundamental de las bicapas lipídicas de todas las membranas celulares sin excepción, sean la membrana plasmática, la envoltura nuclear o las membranas de los orgánulos citoplasmáticos. (2) sirve para impermeabilizar todo tipo de superficies biológicas: el haz de las hojas de las espermatófitas, los frutos de las antófitas, la cutícula de los artrópodos...
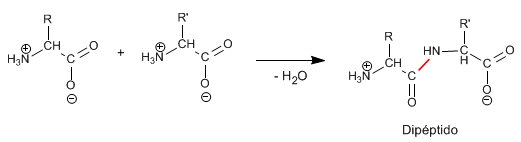
4. Dados los siguientes aminoácidos: (a) Escribir la fórmula del dipéptido que formarían (0,5). 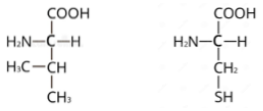 (b) ¿Presentan estos aminoácidos carbonos asimétricos? Razonar la respuesta (0,5). (c) ¿Qué tipos de enlaces intervienen en la estabilización de cada uno de los niveles estructurales de las proteínas? (1,0).
(b) ¿Presentan estos aminoácidos carbonos asimétricos? Razonar la respuesta (0,5). (c) ¿Qué tipos de enlaces intervienen en la estabilización de cada uno de los niveles estructurales de las proteínas? (1,0).
a. Se uniría el carboxilo del aminoácido de la izquierda con el grupo amino del aminoácido de la derecha.
b. El C-α es asimétrico en los 2 casos y en el de todos los aminoácidos proteínicos, salvo en la glicina. Esto es así porque está unido a 4 grupos de átomos diferentes.
c.
- Primario: peptídico.
- Secundario: puentes de hidrógeno entre el grupo -C=O de un enlace peptídico y el grupo -NH de otro.
- Terciario: covalentes, iónicos, puentes de hidrógeno y fuerzas de Van der Waals, en todos los casos entre las cadenas laterales.
- Cuaternario: los mismos que en el nivel terciario.
2024
1. 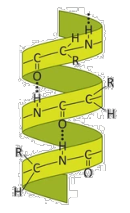 En la figura aparece representada una biomolécula: (a) ¿De qué biomolécula se trata? (0,2) (b) Indique sus componentes esenciales y nombre el tipo de enlace que se establece entre ellos. Describa como se forma este enlace y cite tres características del mismo. (1,0) (c) ¿Qué estructura secundaria es la representada? (0,2) (d) Indique qué enlaces mantienen estable esta estructura y entre qué átomos se forman. (0,6)
En la figura aparece representada una biomolécula: (a) ¿De qué biomolécula se trata? (0,2) (b) Indique sus componentes esenciales y nombre el tipo de enlace que se establece entre ellos. Describa como se forma este enlace y cite tres características del mismo. (1,0) (c) ¿Qué estructura secundaria es la representada? (0,2) (d) Indique qué enlaces mantienen estable esta estructura y entre qué átomos se forman. (0,6)
a. Es una proteína.
b. Los aminoácidos. Enlace peptídico. Se forma por condensación entre el grupo amino de un aminoácido y el grupo carboxilo de otro. Es un enlace covalente, de tipo amida, en el que la presencia de un par de electrones deslocalizados entre los átomos de O, C y N, hace que estos permanezcan en un plano fijo, sin rotación.
c. Es una hélice α. Es mantenida por puentes de hidrógeno formados entre los enlaces peptídicos.
2. En relación al UTP: (a) ¿Qué tipo de biomolécula es? (0,2) (b) ¿Cuáles son sus componentes? (0,6) (c) ¿De qué macromolécula forma parte? (0,2) (d) Indique cuál es la estructura de la macromolécula que contiene el UTP y los tres principales tipos que existen de esta macromolécula. (1,0)
a. Es un nucleótido.
b. Uracilo (base nitrogenada orgánica), ribosa y tres grupos fosfato.
c. Como tal, de ninguna, pero se utiliza en la transcripción para obtener el UMP que forma parte del ARN, tanto el ARN mensajero, como el ARN ribosómico, como el ARN de transferencia, como cualquier otro (nucleolar, micro ARN, ARN largo-no-codificante, etc.).
3.  Contestar las siguientes cuestiones: (a) Identificar el tipo de lípido al que pertenece la molécula que se representa en la figura, indicar su función biológica, sus componentes y los enlaces que los unen. (1,2) (b) Relacionar los compuestos de la columna de la izquierda con las descripciones de la columna de la derecha. (0,8)
Contestar las siguientes cuestiones: (a) Identificar el tipo de lípido al que pertenece la molécula que se representa en la figura, indicar su función biológica, sus componentes y los enlaces que los unen. (1,2) (b) Relacionar los compuestos de la columna de la izquierda con las descripciones de la columna de la derecha. (0,8)
a. Es un fosfolípido. Es el constituyente esencial de las bicapas lipídicas de las membranas celulares. Está formado por 2 ácidos grasos unidos por un enlace éster a una molécula de glicerol, cuyo tercer hidroxilo se une por un enlace éster fosfórico a un grupo fosfato, el cual está unido por otro enlace éster fosfórico a un aminoalcohol (la colina, en este caso).
| Compuesto | Descripción |
|---|---|
| 1. Glucógeno | b. Polisacárido de reserva de células animales |
| 2. Quitina | d. Polímero formado por unidades de N-acetilglucosamina |
| 3. Celulosa | e. Polisacárido estructural en células vegetales |
| 4. Esfingolípidos | g. Su unidad estructural es la ceramida |
| 5. Ceramida | h. Se obtiene por la unión de un ácido graso y la esfingosina. |
| 6. Terpenos | a. Derivan del isopreno |
| 7. Triacilglicerol | c. Lípido saponificable y apolar |
| 8. Colesterol | f. Esterol mayoritario en animales |
4. En relación a las proteínas: (a) Indicar los monómeros que forman estos biopolímeros y describir su estructura. (0,6) (b) ¿Qué tipo de enlace participa en la estructura primaria de las proteínas? Citar dos características de este enlace. (0,6) (c) Indicar cuatro funciones y citar una proteína para cada una de ellas. (0,8)
a. Aminoácidos. Los aminoácidos proteínicos tienen un carbono central (Cα) al que se une un átomo de hidrógeno, un grupo amino, un grupo carboxilo y una cadena lateral específica de cada aminoácido.
b. Enlace peptídico. Se forma por condensación entre el grupo amino de un aminoácido y el grupo carboxilo de otro. Es un enlace covalente, de tipo amida, en el que la presencia de un par de electrones deslocalizados entre los átomos de O, C y N, hace que estos permanezcan en un plano fijo, sin rotación.
c.
- Catalizar reacciones bioquímicas (las enzimas).
- Ayudar al empaquetamiento y organización del ADN celular (las histonas).
- Formar parte de las membranas celulares, donde actúan como canales de transporte de sustancias (bomba de Na+/K+).
- Formar parte de las membranas celulares, donde actúan como moléculas de reconocimiento celular (receptores de hormonas, receptores de neurotransmisores, proteínas del Complejo Mayor de Histocompatibilidad).
- Constituir estructuras tales como la matriz intercelular de tejidos epiteliales (queratina) o conjuntivos (colágeno).
- Transportar sustancias por la sangre (hemoglobina, seroalbúmina, proteínas de los complejos LDL y HDL).
- Identificar antígenos, que son macromoléculas extrañas libres o de la superficie de virus o de células (los anticuerpos).
2023
1. Respecto a los triglicéridos: (a) Indique sus componentes y el tipo de enlace que los une (0,6). (b) ¿En qué consiste la reacción de saponificación? Represente dicha reacción (1). (c) Indique dos funciones de estas biomoléculas (0,4).
(a) Una molécula del alcohol glicerina unida por enlaces éster a 3 moléculas de ácido graso.
(b) Es la rotura de los enlaces éster de un lípido saponificable, separándose cada ácido graso del alcohol al que estaba unido, gracias a la acción de un hidróxido tal como el NaOH, liberándose el alcohol y moléculas de sal de ácido graso (jabón).
(c) Sirven de reserva energética para los seres vivos que las almacenan (aceites de las plantas, sebos de los animales...). Sirven de aislamiento térmico en los animales que las almacenan en posición subcutánea. Sirven de amortiguación mecánica, por ejemplo en las almohadillas grasas de las articulaciones.
2.  Respecto a las proteínas: (a) ¿Cómo se denominan los niveles estructurales indicados como A, B y C en la figura? ¿En cuál de esos niveles la proteína está activa? (0,4). (b) Explique en que consiste el nivel C indicando los tipos de fuerzas que mantienen dicho nivel estructural. ¿Qué tipo de conformación C se muestra en la figura? (1). (c) ¿Cómo se denomina el proceso en el que la proteína cambia del nivel C al A? ¿En qué consiste y cuál es su consecuencia? (0,6).
Respecto a las proteínas: (a) ¿Cómo se denominan los niveles estructurales indicados como A, B y C en la figura? ¿En cuál de esos niveles la proteína está activa? (0,4). (b) Explique en que consiste el nivel C indicando los tipos de fuerzas que mantienen dicho nivel estructural. ¿Qué tipo de conformación C se muestra en la figura? (1). (c) ¿Cómo se denomina el proceso en el que la proteína cambia del nivel C al A? ¿En qué consiste y cuál es su consecuencia? (0,6).
(a) a: estructura primaria; b: estructura secundaria; c: estructura terciaria. La proteína sólo puede estar activa en el nivel estructural terciario o, de haberlo, en el cuaternario.
(b) Es un plegamiento de una única cadena peptídica que presenta regiones con estructura secundaria en hélice α, regiones con estructura secundaria en hoja plegada y codos desorganizados entre ambas, de tal modo que, en conjunto, adquiere una conformación determinada que le permite ser funcional. Es mantenida por enlaces covalentes (puentes disulfuro entre cisteínas enfrentadas), enlaces iónicos (entre aminoácidos básicos y ácidos enfrentados), puentes de hidrógeno (entre aminoácidos polares enfrentados) y fuerzas de Van der Waals (en el resto de los casos); en todos los casos los enlaces tienen lugar entre las cadenas laterales de los aminoácidos. La figura muestra una conformación globular.
(c) Se denomina desnaturalización. Consiste en que la proteína pierde su conformación, normalmente de forma irreversible, a causa de la rotura de algunos de los enlaces que la mantenían, causada esta por variaciones de pH, subida de la temperatura y/o subida de la salinidad del medio. La consecuencia es la pérdida de la funcionalidad de la proteína, al deberse esta a su forma específica.
3.  En relación con la imagen representada, responda a las siguientes cuestiones: (a) Identifique la biomolécula y sus componentes (1). (b) Qué tipos de enlaces señalan las flechas (0,6). (c) Si en el componente 1 se sustituye el radical OH del C2 por un H, ¿qué nombre recibe la biomolécula? (0,2). (d) ¿Qué nombre reciben las macromoléculas que resulta de la unión de estas biomoléculas? (0,2).
En relación con la imagen representada, responda a las siguientes cuestiones: (a) Identifique la biomolécula y sus componentes (1). (b) Qué tipos de enlaces señalan las flechas (0,6). (c) Si en el componente 1 se sustituye el radical OH del C2 por un H, ¿qué nombre recibe la biomolécula? (0,2). (d) ¿Qué nombre reciben las macromoléculas que resulta de la unión de estas biomoléculas? (0,2).
(a) Es el adenosín-monofosfato, un ribonucleótido. Está formada, de izquierda a derecha, por un ácido fosfórico, una ribosa y una adenina.
(b) Enlace éster fosfórico (a la izquierda; entre el ácido y el azúcar) y enlace éster glucosídico (a la derecha; entre el azúcar y la base),
(c) Desoxiadenosín-monofosfato.
(d) Ácidos nucleicos.
4. En relación con las proteínas: (a) Indique dos modelos de estructura secundaria (0,4). (b) ¿Qué enlaces estabilizan la estructura terciaria de las proteínas? (0,5). (c) ¿Cómo se denomina el enlace que estabiliza la estructura primaria? Indique dos características (0,5). (d) Indique qué clase de estructura terciaria tienen las siguientes proteínas: colágeno, enzimas, globulinas y queratina (0,4). (e) ¿Qué diferencia hay entre holoproteínas y heteroproteínas? (0,2).
(a) Hélice α: secuencia de aminoácidos helicoidal, dextrógira, con 3,6 aminoácidos por vuelta y las cadenas laterales hacia afuera, manenida por puentes de hidrógeno entre los enlaces peptídicos. Hoja plegada: secuencia de aminoácidos en línea quebrada o zig-zag que se pliega dando lugar a segmentos paralelos entre los que se forman puentes de hidrógeno entre los enlaces peptídicos; las cadenas laterales quedan, alternativamente, hacia arriba y abajo del plano medio de la hoja plegada.
(b) Enlaces covalentes (puentes disulfuro entre cisteínas enfrentadas), enlaces iónicos (entre aminoácidos básicos y ácidos enfrentados), puentes de hidrógeno (entre aminoácidos polares enfrentados) y fuerzas de Van der Waals (en el resto de los casos); en todos los casos los enlaces tienen lugar entre las cadenas laterales de los aminoácidos.
(c) Enlace peptídico. Es un enlace covalente, de tipo amida, que se da entre el grupo carboxilo de un aminoácido y el grupo amino de otro. En él, la presencia de un par de electrones deslocalizados entre los átomos de O, C y N, hace que estos permanezcan en un plano fijo, sin rotación.
(d) Colágeno: fibrilar. Enzimas: globular. Globulinas: globular. Queratina: fibrilar.
(e) Las primeras están formadas únicamente por aminoácidos. Las segundas tienen, además, una parte no peptídica que, cuando es permanente, se llama grupo prostético y cuando no, cofactor.
2022
1. (a) Explicar el fundamento de la capacidad disolvente del agua. Indicar dos ejemplos de funciones biológicas del agua relacionadas con esta propiedad (0,5). (b) Describir qué es un sistema tampón y poner un ejemplo (0,5). (c) ¿A qué grupo de biomoléculas pertenecen las enzimas? Cuál es su función biológica. Explicar, con la ayuda de un esquema gráfico, la relación de la actividad enzimática con la temperatura (1,0).
(a)
- El agua es un excelente disolvente debido a su carácter polar (el O tiene carga eléctrica parcial negativa y los H la tienen positiva debido a su diferente electronegatividad) por lo que puede establecer interacciones por enlaces de hidrógeno con otras moléculas polares e iones.
- A esta propiedad se debe que sea el vehículo habitual de nutrientes (sangre, savia) y de desechos (orina, sudor).
(b)
- Las sustancias tamponantes tienen la función de tomar protones del medio cuando los hay en exceso y liberar protones al medio cuando los hay en defecto. Esto permite amortiguar los cambios de pH en los fluidos biológicos, como la sangre o el medio interno de las células. Y esto a su vez impide que las proteínas se desnaturalicen por este motivo.
- El sistema ácido carbónico / ión bicarbonato (que actúa en el plasma sanguíneo) o el sistema ácido fosfórico / ión fosfato (que actúa en el citosol de las células).
(c)
- Son proteínas.
- Catalizan de forma específica todas y cada una de las reacciones químicas del metabolismo celular. De este modo, es la presencia de la enzima correspondiente, en la cantidad suficiente, en el lugar adecuado, y en el momento adecuado, la forma que tienen los organismos de inducir una reacción química. Hacen su tarea favoreciendo que alcanzar el estado de activación de una reacción química requiera mucha menos energía. De este modo se consigue que sean espontáneas reacciones que, de otro modo, apenas tendrían lugar.
- Es una gráfica "Actividad enzimática / Temperatura" con forma de campana.
- Por debajo del óptimo de temperatura disminuye la velocidad de las moléculas de E y S, por lo que disminuyen sus posibilidades de encuentro, y de que se forme el complejo enzima-sustrato. Por encima del óptimo se empiezan a romper los enlaces que ayudan a mantener la conformación del enzima, perjudicando a su funcionalidad, y llegando a desnaturalizarlo.
2. (a) Identificar dentro de qué grupo de biomoléculas se pueden incluir los compuestos A, B y C. Especificar una función biológica de cada grupo (1,0). (b) Señalar de los anteriores, qué compuesto/s presenta/n carácter anfipático y/o anfótero. ¿Por qué? (0,70). (c) ¿Qué son las vitaminas? (0,30).

(a)
- Glúcidos (es la fructosa); constituir estructuras estables, como la pared celular de las plantas.
- Proteínas (es el aminoácido glicina); transportar nutrientes por la sangre, como la hemoglobina.
- Lípidos (es un ácido graso, o lo sería si tuviera a menos 12 átomos de carbono); aportar la energía que se transfiere al ATP en la respiración celular.
(b)
- El aminoácido es anfótero porque en el pH habitual de las disoluciones biológicas se encuentra coo ión doble: el grupo carboxilo pierde un protón y el grupo amino lo gana.
- El ácido graso es anfipático porque su grupo carboxilo es polar (o ionizado) y por tanto es hidrófilo (forma puentes de hidrógeno con el agua), mientras que su cadena de metilos es apolar y por tanto es hidrófoba.
(c) Son cofactores orgánicos de enzimas, es decir, son coenzimas. Sin ellas, el enzima del que forman parte no es funcional.
3. En la figura aparecen tres moléculas: (a) ¿Cómo se denomina este grupo de biomoléculas? (0,2). (b) Represente la reacción que se produce al unirse estas tres moléculas en el orden establecido (0,7). (c) Indique el tipo de enlace bioquímico que se forma y cite dos características de dicho enlace (0,6). (d) ¿Qué nombre reciben las macromoléculas formadas por un gran número de estas biomoléculas? Enumere 4 funciones de este tipo de macromoléculas (0,5).

(a) Son aminoácidos.
(b) La reacción debe mostrar la formación de 2 enlaces peptídicos por condensación (se liberan 2 moléculas de agua) entre el carboxilo de la alanina y en grupo amino de la valina; y entre el carboxilo de la valina y el grupo amino de la fenil-alanina. Al final, deben de quedar libres solo el grupo amino de la alanina y el grupo carboxilo de la fenil-alanina.
(c)
- Se llama enlace peptídico.
- Es un enlace covalente, hidrolizable, de tipo amida y sin libertad de rotación para los átomos que lo forman, ya que el N, el C y el O comparten electrones deslocalizados y están siempre en el mismo plano.
(d)
- Se llaman polipéptidos que, con la conformación y las modificaciones postraduccionales adecuadas, pueden llegar a ser proteínas.
- Algunas funciones:
- Catalizar reacciones bioquímicas (las enzimas).
- Ayudar al empaquetamiento y organización del ADN celular (las histonas).
- Formar parte de las membranas celulares, donde actúan como canales de transporte de sustancias.
- Formar parte de las membranas celulares, donde actúan como moléculas de reconocimiento celular (receptores de hormonas, receptores de neurotransmisores, proteínas del Complejo Mayor de Histocompatibilidad).
- Constituir estructuras tales como la matriz intercelular de tejidos epiteliales (queratina) o conjuntivos (colágeno).
- Transportar sustancias por la sangre (hemoglobina, seroalbúmina, proteínas de los complejos LDL y HDL).
- Identificar antígenos, que son macromoléculas extrañas libres o de la superficie de virus o de células (los anticuerpos).
4. Referente a las biomoléculas: (a) Indique una biomolécula con la que relacionaría cada uno de los siguientes tipos de enlace: éster, glucosídico, fosfodiéster, peptídico y especifique entre que moléculas se establece cada enlace (1,0). (b) Especifique la función de los siguientes polisacáridos y en qué tipo de seres vivos se pueden encontrar: almidón, glucógeno, celulosa y quitina. Cite el monosacárido que compone cada uno de ellos y el enlace que los une (1,0).
(a)
- Acilglicérido (trioleína), cera.
- Disacárido (sacarosa), nucleósido (adenosina).
- ADN, ARN.
- Prtteína (colágeno).
(b)
- Reserva de energía. Plantas y algas. α-D-glucosa. O-glucosídico en 1→4, con ramificaciones en 1→6.
- Reserva de energía. Animales y hongos. α-D-glucosa. O-glucosídico en 1→4, con ramificaciones en 1→6.
- Constituir estructuras estables (paredes celulares). Plantas y algas. ß-D-glucosa. O-glucosídico en 1→4.
- Constituir estructuras estables. Hongos (paredes celulares) y artrópodos (exoesqueleto). N-acetil-ß-D-glucosamina. O-glucosídico en 1→4.
2021
1.  En relación con el esquema representado, conteste a las siguientes cuestiones: (a) ¿De qué tipo de biomolécula se trata? Indique el tipo de estructura que corresponde a cada una de las letras señaladas (A, B, C, D y E) (0,6). (b) Indique cuales son los monómeros que forman estas moléculas. Describa el tipo de enlace que participa en la unión de estos monómeros (1,0). (c) Mencione cuatro funciones en las que participen estas biomoléculas (0,4).
En relación con el esquema representado, conteste a las siguientes cuestiones: (a) ¿De qué tipo de biomolécula se trata? Indique el tipo de estructura que corresponde a cada una de las letras señaladas (A, B, C, D y E) (0,6). (b) Indique cuales son los monómeros que forman estas moléculas. Describa el tipo de enlace que participa en la unión de estos monómeros (1,0). (c) Mencione cuatro funciones en las que participen estas biomoléculas (0,4).
(a) Es una proteína. A: Primaria. B: Secundaria (hélice α). C: Secundaria (Conformación ß). D: Terciaria. E: Cuaternaria.
(b)
- Son los aminoácidos.
- Enlace peptídico. Es un enlace covalente, que se forma por condensación (pérdida de una molécula de agua), entre un grupo -NH2 y un grupo -COOH de 2 aminoácidos cercanos. Es un enlace fijo, sin libertad de rotación para los 2 átomos que lo forman.
(c)
- Catalizar reacciones bioquímicas (las enzimas).
- Ayudar al empaquetamiento y organización del ADN celular (las histonas).
- Formar parte de las membranas celulares, donde actúan como canales de transporte de sustancias.
- Formar parte de las membranas celulares, donde actúan como moléculas de reconocimiento celular (receptores de hormonas, receptores de neurotransmisores, proteínas del Complejo Mayor de Histocompatibilidad).
- Constituir estructuras tales como la matriz intercelular de tejidos epiteliales (queratina) o conjuntivos (colágeno).
- Transportar sustancias por la sangre (hemoglobina, seroalbúmina, proteínas de los complejos LDL y HDL).
- Identificar antígenos, que son macromoléculas extrañas libres o de la superficie de virus o de células (los anticuerpos).
2. En relación con las enzimas: (a) Indique tres características fundamentales de las enzimas (0,6). (b) Explique cómo afectaría a la velocidad de una reacción catalizada por una enzima si: i) aumenta la concentración de sustrato, y ii) aumenta la temperatura. Justifique las respuestas (0,6). (c) Defina brevemente los conceptos de holoenzima, apoenzima y cofactor. Cite algún ejemplo de cofactor enzimático (0,8).
(a)
- Son específicas de sustrato: una enzima solo puede actuar sobre un único sustrato o una familia de sustratos químicamente similares.
- Son específicas de reacción: una enzima solo puede catalizar en su sustrato una única clase de reacción (salvo excepciones: la RuBisCO normalmente fija CO2 a la ribulosa-1,5-difosfato, pero si hay mucho O2, es esta molécula la que combina a la ribulosa-1,5-difosfato, oxidándola; a esto se llama fotorrespiración).
- No se consumen durante la reacción, ni se alteran tras ella, por lo que son reutilizables.
- Son desnaturalizables por una elevada temperatura o por variaciones del pH o de la salinidad, como cualquier otra proteína. Esto significa que pierden su conformación, normalmente de forma irreversible.
(b)
- Aumentaría, ya que cuanto más sustrato haya más producto se va a poder formar. Pero solo hasta un nivel máximo que corresponde al punto en que todas las unidades de enzima estén ocupadas.
- Aumentaría, ya que a mayor temperatura mayor es la agitación de enzimas y sustratos, y mayores son son sus probabilidades de encuentro. Pero solo hasta un nivel máximo a partir del cual la enzima. al ser una proteína, se empezaría a desnaturalizar al romperse los enlaces que mantienen su conformación, en el siguiente orden: fuerzas de Van der Waals, puentes de hidrógeno, enlaces iónicos y enlaces covalentes.
(c)
- Holoenzima: enzima formada por una apoenzima y un cofactor.
- Apoenzima: es la parte proteínica de una enzima.
- Cofactor: es la parte no proteínica de una enzima, cuando no es permanente. 2 ejemplos son los cofactores metálicos, como el Fe2+ o el Mg2+. O los cofactores orgánicos (coenzimas) como las vitaminas.
3. (a) Define biomolécula. Indicar dos biomoléculas inorgánicas (0.8). (b) De los 4 grandes grupos de biomoléculas orgánicas identificar aquel o aquellos presentes en cada uno de los siguientes elementos de la lista: Queratina del pelo, Pared celular, Ácidos biliares, Ceras, Ribosoma, Almidón, Albúmina, Nucleosoma, Envuelta nuclear, Colágeno, Hormonas sexuales, Membrana plasmática (1.2).
(a)
- Biomoléculas son las moléculas propias de los seres vivos.
- 2 clases de biomoléculas inorgánicas son las sales minerales, como el CaCO3 y el agua.
(b)
- Queratina del pelo: proteínas.
- Pared celular: proteínas y glúcidos.
- Ácidos biliares: lípidos.
- Ceras: lípidos.
- Ribosoma: proteínas. y ácidos nucleicos.
- Almidón: glúcidos.
- Albúmina: proteínas.
- Nucleosoma: proteínas y ácidos nucleicos.
- Envuelta nuclear: proteínas y lípidos.
- Colágeno: proteínas.
- Hormonas sexuales: lípidos.
- Membrana plasmática: (gluco)proteínas y lípidos.
4. Respecto a los fosfolípidos: (a) ¿Cuáles son sus componentes generales? (0.5). (b) Indique su principal función biológica y en qué propiedad se fundamenta (0.5). (c) Señale las diferencias estructurales con los glucolípidos y los esteroides (0.5). (d) Ponga un ejemplo de un esteroide e indique su función (0.5).
(a) La glicerina a la que se unen 2 ácidos grasos y un grupo fosfato, y a este un aminoalcohol.
(b) Los fosfolípidos son siempre anfipáticos: tienen una parte apolar (los ácidos grasos) y una parte polar (el fosfato y el aminoalcohol). Por ello forman las bicapas lipídicas de las membranas celulares.
(c)
- Los glucolípidos o glucoesfingolípidos tienen 3 componentes: el alcohol esfingosina, un ácido graso (unido al grupo amino de la esfingosina) y una molécula polar, que es un monosacárido o un disacárido.
- Los esteroides son lípidos insaponificables derivados del ciclopentano-perhidro-fenantreno.
(d) Un ejemplo de esteroide es el colesterol, cuya función es, entre otras, estabilizar las membranas celulares o servir de precursor para la síntesis de las hormonas sexuales.
2020
1. (a) ¿Cuándo se dice que un carbono es asimétrico? y ¿A qué da lugar la existencia de un carbono asimétrico? (0,7). (b) ¿Cuáles son los carbonos asimétricos en la D-glucosa? ¿Cuál es el carbono que determina las configuraciones D y L cuando hay más de un carbono asimétrico? (0,6). (c) Escriba y explique brevemente las principales funciones de los glúcidos (0,7).
(a)
- Cuando está unido, por sus 4 enlaces, a 4 grupos químicos diferentes.
- A estereoisómeros, llamados enantiómeros, que desvían la luz polarizada en sentidos opuestos: uno es levógiro (el enantiómero L) y otro dextrógiro (el enantiómero D).
(b)
- El 2, 3, 4 y 5.
- El más alejado del grupo carbonilo.
(c)
- Reserva energética: polisacáridos como el almidón y el glucógeno son almacenados ya que pueden ser hidrolizados fácilmente (sus enlaces O-glucosídicos son α(1→4)) a moléculas de glucosa cuando esta se hace necesaria para producir ATP mediante la respiración celular o la fermentación.
- Estructural: polisacáridos como la celulosa o la quitina son difícilmente hidrolizables (sus enlaces O-glucosídicos son ß(1→4)), por lo que son utilizados para formar estructuras estables como la pared celular de las plantas o los exoesqueletos de los artrópodos, respectivamente.
2. 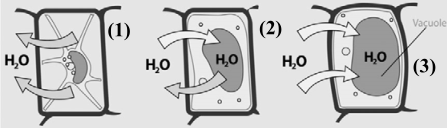 En la figura se representa una célula que está en disoluciones con diferente concentración salina. (a) Explique, ¿cómo tiene que ser la concentración salina de la disolución en cada caso y cómo se puede explicar ese cambio de forma? ¿Cuál es el nombre de este proceso y qué repercusiones tiene en los seres vivos? (1,5). (b) El agua es un excelente disolvente. Explique por qué (0,5).
En la figura se representa una célula que está en disoluciones con diferente concentración salina. (a) Explique, ¿cómo tiene que ser la concentración salina de la disolución en cada caso y cómo se puede explicar ese cambio de forma? ¿Cuál es el nombre de este proceso y qué repercusiones tiene en los seres vivos? (1,5). (b) El agua es un excelente disolvente. Explique por qué (0,5).
(a)
- En (1) la célula está en un medio hipertónico (muy concentrado respecto del citoplasma) ya que el agua se mueve por ósmosis hacia el exterior, provocando la plasmólisis de la célula.
- En (2) el medio es isotónico.
- En (3) el medio es hipotónico (diluido respecto del citoplasma) ya que el agua se mueve por ósmosis hacia el interior, provocando la turgencia de la célula.
- La ósmosis, es decir, la difusión de un disolvente a través de una membrana semipermeable desde una disolución más diluida a otra más concentrada, permite el intercambio de agua ente el interior y el exterior de la célula.
(b) El agua es un excelente disolvente debido a su carácter polar (el O tiene carga eléctrica parcial negativa y los H la tienen positiva debido a su diferente electronegatividad) por lo que puede establecer interacciones por enlaces de hidrógeno con otras moléculas polares e iones.
3. Respecto a los glicerofosfolípidos: (a) ¿Cuáles son sus componentes moleculares? (0,5). (b) ¿Cómo se comportan en un medio acuoso? Razonar la respuesta (0,5). (c) ¿En qué estructuras celulares se pueden encontrar? (0,5). (d) ¿Qué diferencia hay respecto a los esfingolípidos? (0,5).
(a) La glicerina a la que se unen 2 ácidos grasos y un grupo fosfato, y a este un aminoalcohol (la serina, la colina, la etanolamina...).
(b) Los fosfolípidos son siempre anfipáticos: tienen una parte apolar o hidrófoba (los ácidos grasos, cuya carga eléctrica está distribuida simétricamente) y una parte polar o hidrófila (el fosfato y el aminoalcohol, cuya carga eléctrica está distribuida asimétricamente).
(c) Forman las bicapas lipídicas de las membranas celulares.
(d) Los esfingolípidos tienen 3 componentes: el alcohol esfingosina, un ácido graso (entre ambos forman la molécula de ceramida) y una molécula polar (que puede ser un azúcar, la fosforilcolina o la fosforiletanolamina).
4. Indicar, respecto a las siguientes biomoléculas: polisacáridos, triglicéridos, proteínas y ácido desoxirribonucleico: (a) Sus componentes y el tipo de enlace que los une (1,6). (b) Una función de estas biomoléculas (0,4).
(a)
- Polisacáridos: monosacáridos; enlace O-glucosídico.
- Triglicéridos: glicerol y 3 ácidos grasos; enlace éster.
- Proteínas: aminoácidos; enlace peptítico.
- Ácido desoxirribonucleico: nucleótidos; enlace nucleotídico (fosfodiéster).
- Todos son enlaces covalentes.
(b)
- Polisacáridos: estructural: la celulosa o la quitina son difícilmente hidrolizables (sus enlaces O-glucosídicos son ß(1→4)), por lo que son utilizados para formar estructuras estables como la pared celular de las plantas o los exoesqueletos de los artrópodos, respectivamente.
- Triglicéridos: reserva de energía: pueden ser almacenados y luego hidrolizados a glicerina y ácidos grasos, los cuales pueden ser oxidados en la respiración celular para obtener ATP.
- Proteínas: catalizan reacciones químicas (las enzimas).
- Ácido desoxirribonucleico: contiene la información genética. la expresa y la transmite a la descendencia.
2019
1.  (a) En el aminoácido, cuya fórmula se representa, identificar el grupo amino, el carboxilo y la cadena lateral R. ¿Hay algún carbono asimétrico? Razonar la respuesta (0,4). (b) Dentro de la clasificación de aminoácidos, ¿a qué grupo pertenece? (0,2). (c) ¿En qué grupos de biomoléculas aparece el enlace O-glucosídico? y ¿el enlace peptídico? Explicar las principales diferencias entre estos enlaces (0,8). (d) Describir dos funciones biológicas de las sales inorgánicas solubles en agua (0,6).
(a) En el aminoácido, cuya fórmula se representa, identificar el grupo amino, el carboxilo y la cadena lateral R. ¿Hay algún carbono asimétrico? Razonar la respuesta (0,4). (b) Dentro de la clasificación de aminoácidos, ¿a qué grupo pertenece? (0,2). (c) ¿En qué grupos de biomoléculas aparece el enlace O-glucosídico? y ¿el enlace peptídico? Explicar las principales diferencias entre estos enlaces (0,8). (d) Describir dos funciones biológicas de las sales inorgánicas solubles en agua (0,6).
(a)
- Grupo amino: NH3+.
- Grupo carboxilo: COO-.
- Cadena lateral: CH2-CH2-S-CH3
- El Cα (el C al que están unidos los grupos amino y carboxilo) es asimétrico porque está unido a 4 grupos diferentes.
(b) Es neutro (ni ácido ni básico, porque no tiene carga) y apolar (sin grupos hidroxilo o amino en la cadena lateral).
(c)
- En los glúcidos.
- En las proteínas.
- El peptídico es un enlace covalente entre un N y un C de 2 aminoácidos diferentes. El O-glucosídico es un enlace covalente entre 2 C de dos monosacáridos diferentes con un O en medio.
(d) Iones como el HCO3- o el PO43+ tienen efecto amortiguador de las variaciones de pH. También mantienen la concentración salina y por tanto la osmolaridad de las células, evitando la pérdida o la entrada de agua en grandes cantidades.
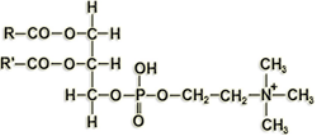
2.  (a) Identificar a qué tipo de lípido pertenece la siguiente estructura indicando sus principales componentes (1,1). (b) Explicar si se trata de una molécula anfipática (0,6). (c) ¿Cuál es la principal función biológica de este tipo de lípidos? (0,3). (d) Definir los siguientes términos: enzima, coenzima y Km.
(a) Identificar a qué tipo de lípido pertenece la siguiente estructura indicando sus principales componentes (1,1). (b) Explicar si se trata de una molécula anfipática (0,6). (c) ¿Cuál es la principal función biológica de este tipo de lípidos? (0,3). (d) Definir los siguientes términos: enzima, coenzima y Km.
(a) Es un fosfolípido en el que se ve la glicerina a la que se unen 2 ácidos grasos y un grupo fosfato, y a este un aminoalcohol (la serina).
(b) Los fosfolípidos son siempre anfipáticos: tienen una parte apolar (los ácidos grasos) y una parte polar (el fosfato y el aminoalcohol).
(c) Forman la bicapa lipídica de las membranas celulares.
(d)
- Enzima: proteína que cataliza (acelera) una determinada reacción bioquímica.
- Coenzima: es un complemento orgánico no permanente de una heteroproteína; un ejemplo es una vitamina.
- KM es la concentración de sustrato a la que una enzima alcanza la mitad de la velocidad máxima a la que puede catalizar su rección bioquímica.
3. En relación a las proteínas: (a) ¿Cuáles son las unidades estructurales de las proteínas? Escriba la fórmula general de estas unidades estructurales (0,8). (b) ¿Cómo se llama el enlace que une esas unidades estructurales y cuáles son las principales características de ese enlace? Represente la unión de dos de esas unidades estructurales. ¿Qué nombre recibe la molécula resultante? (1,0). (c) Indique dos funciones de las proteínas (0,2).
(a)
- Aminoácidos.
- Cα central unido a un grupo amino, un grupo carboxilo, un H y una cadena lateral (R).
(b)
- Enlace peptídico. Es un enlace covalente, que se forma por condensación (pérdida de una molécula de agua), entre un grupo -NH2 y un grupo -COOH de 2 aminoácidos cercanos. Es un enlace fijo, sin libertad de rotación para los 2 átomos que lo forman.
- Dipéptido. Ver dibujo en el libro, p. 68 arriba a la derecha.
(c)
- Catalizar reacciones bioquímicas (las enzimas).
- Ayudar al empaquetamiento y organización del ADN celular (las histonas).
- Formar parte de las membranas celulares, donde actúan como canales de transporte de sustancias.
- Formar parte de las membranas celulares, donde actúan como moléculas de reconocimiento celular (receptores de hormonas, receptores de neurotransmisores, proteínas del Complejo Mayor de Histocompatibilidad).
- Constituir estructuras tales como la matriz intercelular de tejidos epiteliales (queratina) o conjuntivos (colágeno).
- Transportar sustancias por la sangre (hemoglobina, seroalbúmina, proteínas de los complejos LDL y HDL).
- Identificar antígenos, que son macromoléculas extrañas libres o de la superficie de virus o de células (los anticuerpos).
4. Respecto del agua: (a) Dibuje cómo se forman los enlaces por puentes de hidrógeno entre dos moléculas de agua. ¿Por qué estas moléculas forman enlaces por puentes de hidrógeno? (1,0). (b) Indique 4 propiedades del agua que se deben a su tendencia a formar enlaces de hidrógeno (0,4). (c) Explique la diferencia entre ósmosis, difusión y diálisis (0,6).
(a)
- Ver dibujo en el libro, p. 14. Tiene que mostrar al O con carga parcial negativa y a cada H con media carga parcial positiva.
- Estas cargas eléctricas parciales se deben a que en la molécula de agua, el O forma un enlace covalente con cada H, pero al ser más electronegativo el O que los H, atraen a los electrones que comparten hacia sí. El enlace se forma por la atracción electrostática entre un O (negativo) de una molécula y un H (positivo) de otra.
(b)
- La cohesividad de una molécula de agua con otras.
- La adhesividad a superficies.
- La capilaridad que deriva de las 2 anteriores.
- El elevado calor específico del agua.
- El elevado calor latente de fusión y calor latente de vaporización del agua.
- La elevada densidad del agua líquida.
(c)
- Difusión es el movimiento de los solutos a favor de gradiente (disolución más concentrada a disolución más diluida).
- Ósmosis es el movimiento del agua a favor de potencial hídrico (disolución más diluida a disolución más concentrada); sucede cuando una membrana semipermeable (como las membranas celulares) permite el movimiento del agua pero no el de los solutos.
- La diálisis es una difusión de algunos de los solutos de una disolución (los más pequeños) pero no de otros (los más grandes) a través de una membrana semipermeable. Vídeo: Difusión, Ósmosis y Diálisis.
2018
1. Sobre los siguientes glúcidos: celulosa, fructosa, sacarosa y almidón: (a) Indique qué tipos de glúcidos son y cuáles son sus componentes (0,5). (b) Explique en qué consiste el enlace O-glucosídico. Señale cuáles de las moléculas anteriores tienen este enlace, especificar el tipo de enlace glucosídico y entre qué carbonos se establecen (1,0). (c) Razone si las biomoléculas citadas tienen carácter reductor (0,5).
(a)
- Celulosa: un polisacárido formado por moléculas de glucosa unidas en ß(1→4).
- Fructosa: un monosacárido.
- Sacarosa: un disacárido formado por una molécula de fructosa y una de glucosa unidas en ß(2→1).
- Almidón: un polisacárido formado por moléculas de glucosa unidas en α(1→4).
(b)
- El enlace O-glucosídico es un enlace covalente entre 2 C de dos monosacáridos diferentes con un O en medio, formado por condensación (con liberación de una molécula de agua).
- Existe en la celulosa, la sacarosa y el almidón, entre los C que se han indicado.
(c) Sólo tienen carácter reductor aquellas que tienen el C carbonilo libre. Entre las moléculas anteriores, sólo es el caso de la fructosa, por ser un monosacárido. Los polisacáridos nunca tienen carácter reductor. Y los disacáridos, sólo aquellos en que el enlace es monocarbonílico, pero en la sacarosa es dicarbonílico.
2. En relación al agua: (a) ¿Por qué las moléculas de agua forman enlaces de hidrógeno entre ellas? (0,5). (b) Indique al menos 3 propiedades del agua y por qué son importantes para los seres vivos (1,0). (c) Entre las moléculas que se disuelven en el agua están las sustancias amortiguadoras o tampones. ¿Qué función tienen y cuál es su importancia para los seres vivos? (0,5).
(a) Porque en la molécula de agua, el O forma un enlace covalente con cada H, pero al ser más electronegativo el O que los H, atraen a los electrones que comparten hacia sí. Esto deja al O con una carga parcial negativa y a cada H con media carga parcial positiva. El enlace se forma por la atracción electrostática entre un O (negativo) de una molécula y un H (positivo) de otra.
(b)
- La cohesividad de una molécula de agua con otras, la adhesividad a superficies y la capilaridad que deriva de las 2 anteriores: esto es esencial para permitir el ascenso de la savia bruta por los vasos leñosos del xilema de las plantas vasculares.
- El elevado calor específico del agua, su elevado calor latente de fusión y su elevado calor latente de vaporización del agua: esto es esencial para que el agua de los fluidos biológicos (sangre, savia…) cambie muy poco de temperatura y casi nunca de estado.
- Su carácter dipolar permite que sea un gran disolvente de todo tipo de moléculas polares, por lo que se le llama "el disolvente universal".
- La mayor densidad del agua líquida que el agua sólida: permite que los lagos y lagunas no se congelen por completo en invierno, sino solo superficialmente, lo que permite que la vida continúe, aún con actividad muy ralentizada.
- La elevada tensión superficial del agua: permite la existencia de seres vivos que vivan sobre el agua, como las algas llamadas sargazos o los insectos llamados zapateros.
(c) Las sustancias tamponantes como el sistema ácido carbónico / ión bicarbonato o el sistema ácido fosfórico / ión fosfato tienen la función de tomar protones del medio cuando los hay en exceso y liberar protones al medio cuando los hay en defecto. Esto permite amortiguar los cambios de pH en los fluidos biológicos, como la sangre o el medio interno de las células. Y esto a su vez impide que las proteínas se desnaturalicen por este motivo.
3. Respecto a las proteínas: (a) Represente el enlace que se establece entre los aminoácidos e indique sus características (0,4). (b) Explique las características de la estructura secundaria en alfa-hélice. Indique las diferencias con la conformación ß (0,8). (c) ¿Qué es la estructura terciaria y qué tipos de enlaces la estabilizan? (0,8).
(a) Enlace peptídico. Es un enlace covalente, que se forma por condensación (pérdida de una molécula de agua), entre un grupo -NH2 y un grupo -COOH de 2 aminoácidos cercanos. Es un enlace fijo, sin libertad de rotación para los 2 átomos que lo forman.
(b)
- Ambas se forman por el establecimiento de puentes de H entre el grupo -NH de un enlace peptídico y el grupo -C=O de otro. Las cadenas laterales no intervienen.
- En el caso de la α-hélice, da lugar a un enrollamiento helicoidal de la cadena peptídica, con 3,6 aminoácidos por vuelta. Es un enrollamiento dextrógiro (en sentido horario) y con las cadenas laterales proyectadas hacia afuera.
- En el caso de la conformación ß, da lugar a la formación de una hoja plegada en zigzag con varias series de aminoácidos en paralelo, en la que las cadenas laterales quedan hacia arriba y hacia debajo de la hoja, alternativamente.
(c)
- Es el último nivel de plegamiento de una cadena peptídica, y que finaliza su conformación o estructura tridimensional, de la que depende su función.
- Se debe a enlaces entre cadenas laterales, de las siguientes clases, en orden de mayor a menor fortaleza:
- covalentes (puentes disulfuro entre 2 cisteínas);
- iónicos (entre aminoácidos ácidos y aminoácidos básicos);
- puentes de hidrógeno (entre aminoácidos polares);
- fuerzas de Van der Waals (entre aminoácidos apolares).
4.  (a) ¿A qué tipo de biomolécula pertenece el compuesto de la figura? Indique sus componentes estructurales (0,8). (b) Indique la diferencia entre los ácidos grasos saturados e insaturados teniendo en cuenta su conformación (0,8). (c) Cite dos ejemplos de lípidos con función estructural y dos con función energética (0,4).
(a) ¿A qué tipo de biomolécula pertenece el compuesto de la figura? Indique sus componentes estructurales (0,8). (b) Indique la diferencia entre los ácidos grasos saturados e insaturados teniendo en cuenta su conformación (0,8). (c) Cite dos ejemplos de lípidos con función estructural y dos con función energética (0,4).
(a)
- Es un esfingolípido.
- Tiene 3 componentes:
- el alcohol esfingosina (no sombreada),
- un ácido graso (sombreado),
- una molécula polar (X).
(b)
- Los ácidos grasos saturados, como el de la imagen, carecen de dobles enlaces por estar saturados de H, y por tanto carecen de codos, por lo que son lineales.
- Los insaturados, por el contrario, presentan dobles enlaces, y en cada uno de ellos un codo, donde la molécula cambia de dirección, por lo que no es lineal. Esto reduce la posibilidad de establecer fuerzas de atracción con otros ácidos grasos contiguos, lo que rebaja el punto de fusión de estos a.g.
(c)
- Estructurales: los fosfolípidos, esfingolípidos y colesterol de las membranas celulares.
- Energéticos: los acilglicéridos o grasas; tambien los carotenoides, que son pigmentos fotosintéticos y, como tales, capturan la energía de la luz; también valdría el fitol, por ser un componente de la clorofila, otro pigmento fotosintético.
2017
1. Respecto a las biomoléculas: (a) ¿A qué grupo de biomoléculas pertenecen las enzimas? Describir dos de sus principales características (0,5). (b) Explicar con la ayuda de un gráfico el efecto de la concentración de sustrato sobre la velocidad de una reacción catalizada por una enzima (1,0). (c) Definir los siguientes términos: coenzima y centro activo (0,5).
(a)
- Son proteínas.
- Propiedades:
- Son específicas de sustrato: una enzima solo puede actuar sobre un único sustrato o una familia de sustratos químicamente similares.
- Son específicas de reacción: una enzima solo puede catalizar en su sustrato una única clase de reacción (salvo excepciones: la RuBisCO normalmente fija CO2 a la ribulosa-1,5-difosfato, pero si hay mucho O2, es esta molécula la que combina a la ribulosa-1,5-difosfato, oxidándola: esto es la fotorrespiración).
- No se consumen durante la reacción, ni se alteran tras ella, por lo que son reutilizables.
- Son desnaturalizables por una elevada temperatura o por variaciones del pH o de la salinidad, como cualquier otra proteína. Esto significa que pierden su conformación, normalmente de forma irreversible.
(b)  La mayor concentración del sustrato aumenta la velocidad de reacción hasta un determinado punto, en el que la cantidad de sustrato excede de la que los enzimas pueden procesar simultáneamente.
La mayor concentración del sustrato aumenta la velocidad de reacción hasta un determinado punto, en el que la cantidad de sustrato excede de la que los enzimas pueden procesar simultáneamente.
(c)
- Coenzima: es la parte no proteínica de una heteroenzima cuando no es permanente y es orgánica.
- Centro activo: es la parte de una enzima que se une al sustrato.
2.  (a) ¿A qué tipo de biomolécula pertenece el compuesto de la figura? Indicar sus principales características químicas y estructurales (0,5). (b) Identificar en la figura el carbono anomérico. ¿Se trata de un anómero alfa o beta? Razonar la respuesta (0,5). (c) Explicar si este compuesto presenta poder reductor (0,5). (d) Poner dos ejemplos de homopolisacáridos y dos de heteropolisacáridos (0,5).
(a) ¿A qué tipo de biomolécula pertenece el compuesto de la figura? Indicar sus principales características químicas y estructurales (0,5). (b) Identificar en la figura el carbono anomérico. ¿Se trata de un anómero alfa o beta? Razonar la respuesta (0,5). (c) Explicar si este compuesto presenta poder reductor (0,5). (d) Poner dos ejemplos de homopolisacáridos y dos de heteropolisacáridos (0,5).
(a)
- Es el monosacárido fructosa.
- Como todos los monosacáridos, es sólido a temperatura ambiente, cristalino, dulce, soluble en agua, incoloro y tiene poder reductor.
- Es una cetohexosa ciclada pentagonalmente (furanosa).
(b)
- Es el carbono 2 (al que va unido un -OH y un CH2OH.
- Es un anómero α por que en la fórmula ciclada el hidroxilo del carbono anomérico apuna hacia abajo.
(c) Todos los monosacáridos tienen poder reductor porque su carbono anomérico no está participando de ningún enlace O-glucosídico y por lo tanto está libre para poder donar electrones.
(d)
- Homopolisacáridos: almidón, glucógeno, celulosa y quitina.
- Heteropolisacáridos: hemicelulosas, gomas, mucílagos.
3. Respecto a la lipasa y la amilasa: (a) ¿Qué tipo de moléculas son y cuál es su función? ¿Cómo se clasifica este grupo de moléculas? (0,75). (b) ¿Qué factores afectan a su actividad? ¿Qué diferencia hay entre estas moléculas y los cofactores? (0,75). (c) ¿Sobre qué moléculas específicas actúan la lipasa y la amilasa? (0,5).
(a)
- Son enzimas digestivas: catalizan las reacciones de digestión por hidrólisis de macromoléculas orgánicas a sustancias más sencillas, tanto fuera de las células (como en el tubo digestivo) como dentro de sus lisosomas.
- Son hidrolasas.
(b)
- La temperatura: a mayor temperatura, más actividad, hasta llegar al punto en que comienzan a desnaturalizarse.
- El pH: cada enzima tiene un pH óptimo, en el que su actividad es máxima, y lejos del cual se desnaturaliza al deshacerse las fuerzas electrostáctcas (iónicas y puentes de H) que contribuyen a su conformación (esructuras terciaria y cuaternaria, en concreto).
- La concentración del sustrato: cuanto mayor sea, mayor será la actividad del enzima, hasta el punto en que todas las unidades se encuentren saturadas.
- Cuando una enzima es una heteroproteína, es decir, tiene una parte no proteínica, se llama cofactor a esa parte no proteínica, en el caso de que no sea permanente.
(c)
- La lipasa hidroliza los acilglicéridos (grasas) a glicerina y ácidos grasos.
- La amilasa hidroliza el almidón y el glucógeno a maltosa.
4. Respecto a las proteínas: (a) Dibuje la fórmula general de un aminoácido (0,5). (b) ¿Qué es el punto isoeléctrico de un aminoácido? (0,5). (c) ¿Qué son los aminoácidos esenciales? (0,5). (d) Señale las diferencias entre proteínas globulares y fibrosas y ponga un ejemplo de cada una de ellas (0,5).
(a) 
(b) Aquel en el que se su carga eléctrica es nula; el aminoácido se encuentra en estado de ion doble.
(c) Aquellos que no somos capaces de producir a partir de otros precursores y hemos de tomarlos directamente en la dieta.
(d)
- Las proteínas globulares, como la globina (de la hemoglobina), las histonas, el fibrinógeno o la RuBisCO (como todas las enzimas) son solubles en fluidos biológicos porque ocultan sus cadenas laterales hidrófobas en su interior.
- Las proteínas fibrilares, como la fibrina o el colágeno, no son hidrosolubles porque han de aglomerarse con otras similares para poder ocultar sus cadenas laterales hidrófobas de los medios acuosos y, al hacerlo, precipitan.
2016
1.  Respecto a la biomolécula representada: (a) Señale de qué biomolécula se trata (2). (b) Identifique sus principales componentes y especifique el tipo de enlace que está señalado con la flecha (2,5) c) ¿Es una molécula soluble en agua? Razone la respuesta (2). (d) Explique qué es la saponificación y razone si esta biomolécula es saponificable o no (2,5). (e) Indique una de sus funciones (1).
Respecto a la biomolécula representada: (a) Señale de qué biomolécula se trata (2). (b) Identifique sus principales componentes y especifique el tipo de enlace que está señalado con la flecha (2,5) c) ¿Es una molécula soluble en agua? Razone la respuesta (2). (d) Explique qué es la saponificación y razone si esta biomolécula es saponificable o no (2,5). (e) Indique una de sus funciones (1).
(a) Un triacilglicérido o triglicérido.
(b)
- Una molécula de propanotriol, glicerol o glicerina y 3 ácidos grasos.
- Enlace éster.
(c) No, porque no tiene grupos polares libres.
(d)
- La saponificación es similar a la hidrólisis y consiste en la rotura del enlace éster, en lugar de con una molécula de agua, con un hidróxido, tal como la sosa (NaOH). Tras ella la glicerina se regenera y se forman 3 sales de ácido graso o jabones.
- Esta molécula es saponificable por tener enlaces éster.
(e)
- Los acilglicéridos se utilizan como moléculas de reserva energética tanto en plantas (grasas líquidas o aceites) como en animales (grasas sólidas o sebos). Esto es así porque se pueden degradar oxidativamente en las mitocondrias, rindiendo el doble de ATP por gramo que la misma cantidad de glúcidos.
- También se utilizan para formar estructuras subsuperficiales que dificulten la pérdida de calor por el cuerpo, como el panículo adiposo de los mamíferos.
- Los acilglicéridos también se utilizan en estructuras amortiguadoras de golpes, tal como el espermaceti de los cachalotes,
2. Respecto a los glúcidos: (a) ¿Cómo se clasifican estas biomoléculas según el número de monómeros que las forman? Cite dos ejemplos de cada uno de los grupos señalados (3). (b) Dibuje la estructura química de una D-cetohexosa (2). (c) Defina carbono asimétrico y señale los carbonos asimétricos que posee la molécula dibujada en el apartado b). Explique por qué la cetohexosa dibujada es D (3). (d) ¿Qué es un enantiómero? y ¿Qué es un epímero? (2).
(a)
- Monosacáridos: 1 monómero. Glucosa, fructosa, galactosa, ribosa.
- Oligosacáridos: 2-10 monómeros. Sacarosa, maltosa, celobiosa.
- Polisacáridos: > 10 monómeros. Almidón, glucógeno, celulosa, quitina.
(b) La D-Fructosa: 
(c)
- Aquel que se une a 4 grupos funcionales diferentes.
- El 3, 4 y 5.
- Porque el grupo hidroxilo del último carbono asimétrico en la proyección de Fischer está a la derecha.
(d)
- Los enantiómeros son estereoisómero que además son imágenes especulares el uno del otro. Conservan el mismo nombre de sustancia. D-glucosa y L-glucosa
- Los epímeros son estereoisómeros que no son imágenes especulares el uno del otro. Son sustancias diferentes. D-glucosa y D-galactosa.
3. Conteste a las siguientes cuestiones: (a) Defina el fenómeno de ósmosis. ¿Qué es la plasmólisis y cómo se produce? (2). (b) ¿Qué función tienen en los sistemas biológicos el par carbonato-bicarbonato (CO32- / HCO3-) y el par monofosfato-bifosfato (H2PO4- / HPO42-)? ¿Qué nombre reciben estos sistemas? (2). (c) ¿Cuál es la diferencia entre una aldosa y una cetosa? ¿Los monosacáridos tienen carácter reductor? Razonar la respuesta (4). (d) Describa brevemente dos funciones biológicas de los lípidos (2).
(a) La ósmosis es el movimiento del disolvente (agua, en un fluido biológico), desde la disolución con mayor potencial hídrico (o más diluida) a la disolución con menor potencial hídrico (o más concentrada) a través de una membrana semipermeable que impide o dificulta el movimiento de los solutos.
(b) Se llaman sistemas tampón y tienen la utilidad de ser capaz de donar protones en medios básicos y de aceptar protones en medios ácidos, amortiguando así los cambios de pH de los fluidos biológicos y asegurando la estabilidad del ambiente químico que necesitan las proteínas para no desnaturalizarse.
(c) Las aldosas son monosacáridos cuyo grupo carbonilo es terminal; en las cetosas no lo es.
(d) Sí, porque el grupo carbonilo está libre (y no participando en ningún enlace O-glucosídico) y puede, por tanto, donar protones.
(e)
- Los acilglicéridos (grasas) se utilizan como moléculas de reserva energética tanto en plantas (grasas líquidas o aceites) como en animales (grasas sólidas o sebos). Esto es así porque se pueden degradar oxidativamente en las mitocondrias, rindiendo el doble de ATP por gramo que la misma cantidad de glúcidos.
- Los acilglicéridos también se utilizan para formar estructuras subsuperficiales que dificulten la pérdida de calor por el cuerpo, como el panículo adiposo de los mamíferos.
- Los acilglicéridos también se utilizan como estructuras amortiguadoras de golpes, como el espermaceti de los cachalotes,
- Las ceras sirven para impermeabilizar superficies, tales como la cutícula de los artrópodos o el haz de las hojas de las plantas.
- Los carotenoides son pigmentos fotosintéticos y, como tales, captan la energía de la luz. También el fitol, por ser un componente de la clorofila, otro pigmento fotosintético.
- Constituyen estructuras biológicas, como las membranas celulares, en las que participan los fosfolípidos, esfingolípidos y colesterol.
4. Responda a las siguientes cuestiones en base a la figura adjunta: 
(a) Indique a qué tipo de biomoléculas pertenecen (i) y (ii). ¿Qué representan R1 y R2 ? (2). (b) Complete la reacción desarrollando la estructura del compuesto (iii). (3). (c) ¿Cómo se denomina el enlace formado en el compuesto (iii)? Indique las principales características de este tipo de enlace (3). (d) ¿Qué nombre reciben las biomoléculas formadas por gran número de monómeros unidos por enlaces de este tipo? Describa dos funciones biológicas de estas biomoléculas (2).
(a)
- Son aminoácidos.
- Es la parte específica de cada aminoácido, llamada "cadena lateral".
(b) Dipéptido:
(c)
- Peptídico.
- Es un enlace covalente, formado por condensación (se libera una molécula de agua) entre el grupo amino de un aminoácido y el grupo carboxilo de otro. Es un enlace rígido que impide el giro relativo de los aminoácidos unidos a través de él.
(d)
- Polipéptidos, que cuando alcanzan la conformación (estructura tridimensional) que les permite desarrollar su papel biológico, se denominan proteínas.
- Entre sus funciones están:
- Catalizar reacciones bioquímicas (las enzimas).
- Ayudar al empaquetamiento y organización del ADN celular (las histonas).
- Formar parte de las membranas celulares, donde actúan como canales de transporte de sustancias.
- Formar parte de las membranas celulares, donde actúan como moléculas de reconocimiento celular (receptores de hormonas, receptores de neurotransmisores, proteínas del Complejo Mayor de Histocompatibilidad).
- Constituir estructuras tales como la matriz intercelular de tejidos epiteliales (queratina) o conjuntivos (colágeno).
- Transportar sustancias por la sangre (hemoglobina, seroalbúmina, proteínas de los complejos LDL y HDL).
- Identificar antígenos, que son macromoléculas extrañas libres o de la superficie de virus o de células (los anticuerpos).
2015
1. En relación a los glúcidos: (a) Respecto al almidón, el glucógeno y la celulosa (8): (I) ¿Qué tipo de glúcidos son? (II) Describa la estructura de cada uno de ellos, incluyendo sus componentes y el tipo de enlace que los une (III) Indique su función (b) Explique en qué consiste el enlace O-glucosídico y defina carbono anomérico (2).
(a)
- Son polisacáridos.
- En todos los casos están constituidos por unidades de glucosa unidas mediante enlaces O-glucosídicos.
- Almidón:
- α-D-glucosas unidas mediante enlaces 1→4 en cadenas sin ramificar (amilosa) y ramificadas con enlaces en 1→6 (amilopectina).
- reserva energética en las plantas.
- Glucógeno:
- α-D-glucosas unidas mediante enlaces 1→4 en cadenas ramificadas con enlaces en 1→6.
- reserva energética en animales y hongos.
- Celulosa:
- ß-D-glucosas unidas mediante enlaces 1→4 en cadenas sin ramificar.
- constituye un componente esencial de la pared de las células vegetales.
(b)
- El enlace O-glucosídico es un enlace covalente entre 2 monosacáridos, que se forma por condensación (se pierde una molécula de agua) y en el que participa al menos 1 grupo carbonilo.
- El C anomérico es el C carbonilo de un monosacárido cuando este adopta la forma ciclada; este C pasa a ser asimétrico, con lo que se originan 2 nuevos estereoisómeros: los anómeros α y ß.
2. Respecto al ácido ribonucleico (ARN): (a) Indique el nombre de los monómeros que lo forman (1). (b) ¿Cuáles son los componentes de esos monómeros? (3). (c) Cite 3 tipos de ARN y describa su función (4). (d) Describa la estructura de uno de los tipos de ARN citados (2).
(a) Ribonucleótidos.
(b) Una molécula de ribosa, un grupo fosfato y una base nitrogenada orgánica de entre las 4 siguientes: adenina, uracilo, citosina y guanina.
(c)
- ARN mensajero: lleva el mensaje de un gen hasta los ribosomas para que sea traducido a una cadena polipeptídica, que será después convertida a proteína.
- ARN de transferencia: porta los aminoácidos a los ribosomas para que se pueda fabricar la cadena polipeptídica de la proteína.
- ARN ribosómico: forma parte de los ribosomas, y como tal, contribuye a la biosíntesis de proteinas.
(d) Cualquiera de ellos es una secuencia monocatenaria de ribonucleótidos unidos mediante enlaces fosfodiéster entre el grupo 5'-fosfato de un nucleótido y el grupo 3'-OH de otro. En el ARNt la cadena forma bucles debido a apareamientos intracatenarios que forman brazos.
3. (a) Enumerar los cuatro niveles de estructura de las proteínas (2). (b) Indicar qué tipos de enlaces intervienen en la estabilización de cada uno de estos niveles estructurales (4). (c) Especificar la estructura que caracteriza a las α-queratinas (2). (d) Describir dos propiedades generales de las proteínas (2).
(a)
- Primario: es la secuencia de aminoácidos.
- Secundario: es un primer nivel de plegamiento.
- Terciario: es un segundo nivel de plegamiento.
- Cuaternario: es la unión de 2 o más protómeros para formar una proteína funcional. Sólo se da en algunos casos.
(b)
- Primario: peptídico.
- Secundario: puentes de hidrógeno entre el grupo -C=O de un enlace peptídico y el grupo -NH de otro.
- Terciario: covalentes, iónicos, puentes de hidrógeno y fuerzas de Van der Waals, en todos los casos entre las cadenas laterales.
- Cuaternario: los mismos que en el nivel terciario.
(c)
- Se denomina α-hélice.
- Se forma por el establecimiento de puentes de H entre el grupo -NH de un enlace peptídico y el grupo -C=O de otro. Las cadenas laterales no intervienen.
- Da lugar a un enrollamiento helicoidal de la cadena peptídica, con 3,6 aminoácidos por vuelta. Es un enrollamiento dextrógiro (en sentido horario) y con las cadenas laterales proyectadas hacia afuera.
(d)
- Las globulares, al poder esconder sus cadenas laterales apolares en su interior, son solubles. Las fibrilares, para poder ocultar sus cadenas laterales apolares del agua, se unen unas a otras, formando agregados insolubles.
- Su función depende de su conformación (de su forma). Cuando pierden su forma (desnaturalización) pierden su función, y suele ser de forma irreversible. Los motivos para esto pueden ser una elevación de la temperatura, una elevación de la concentración salina o cambios en el pH que alteren las cargas eléctricas de las cadenas laterales, deshaciendo enlaces electrostáticos (iónicos y por puentes de hidrógeno) de las estructuras terciaria y cuaternaria.
- Son muy específicas:
- cada especie tiene proteínas que las demás especies no tienen;
- en distintas especies, proteínas con la misma función, tienes estrcuturas primarias algo diferentes.
- las hay específicas de cada individuo, como las proteínas del Complejo Mayor de Histocompatibilidad (CMH o MHC), que funcionan como antígenos de superficie de cada célula de un mamífero, y que permiten a sus leucocitos (linfocitos) reconocerlas como propias.
4.  (a) A qué grupo de lípidos pertenece el compuesto que se representa en la figura. Identificar sus componentes (3). (b) ¿Se trata de una molécula anfipática? ¿Es un lípido saponificable? Razonar la respuesta (3). (c) Explicar la diferencia desde el punto de vista químico entre los aceites (grasas líquidas a temperatura ambiente) y los sebos o mantecas (2). (d) Describir dos funciones biológicas de los lípidos (2).
(a) A qué grupo de lípidos pertenece el compuesto que se representa en la figura. Identificar sus componentes (3). (b) ¿Se trata de una molécula anfipática? ¿Es un lípido saponificable? Razonar la respuesta (3). (c) Explicar la diferencia desde el punto de vista químico entre los aceites (grasas líquidas a temperatura ambiente) y los sebos o mantecas (2). (d) Describir dos funciones biológicas de los lípidos (2).
(a)
- Es un esfingolípido; en concreto una esfingomielina.
- Tiene 3 componentes:
- el alcohol esfingosina,
- un ácido graso (unido al grupo amino de la esfingosina),
- una molécula polar, la fosforilcolina (la región inferior de la molécula; es por esto que es una esfingomielina y no un glucoesfingolípido).
(b)
- Los esfingolípidos son siempre anfipáticos: tienen una parte apolar (la unión de la esfingosina y el ácido graso, llamada ceramida) y una parte polar (en este caso, la fosforilcolina).
- Los esfingolípidos son saponificables por tener un ácido graso, cuyo enlace con la esfingosina se puede hidrolizar o saponificar.
(c)
- Ambos son acilglicéridos.
- Los sebos son acilglicéridos sólidos a temperatura ambiente, por tener puntos de fusión altos.
- Los aceites son acilglicéridos líquidos a temperatura ambiente, por tener puntos de fusión bajos. Esto puede deberse a que sus ácidos grasos son de cadena más corta o a que sus ácidos grasos son insaturados y, por lo tanto, tienen codos, no son lineales. En ambos casos se forman menos puentes de hidrógeno entre unas moléculas y otras y de ahí su menor punto de fusión.
(d)
- Los acilglicéridos (grasas) se utilizan como moléculas de reserva energética tanto en plantas (aceites) como en animales (sebos o mantecas). Esto es así porque se pueden degradar oxidativamente en las mitocondrias, rindiendo el doble de ATP por gramo que la misma cantidad de glúcidos.
- Los acilglicéridos también se utilizan para formar estructuras subsuperficiales que dificulten la pérdida de calor por el cuerpo, como el panículo adiposo de los mamíferos.
- Los acilglicéridos también se utilizan en estructuras amortiguadoras de golpes, como el espermaceti de los cachalotes,
- Las ceras sirven para impermeabilizar superficies, tales como la cutícula de los artrópodos o el haz de las hojas de las plantas.
- Los carotenoides son pigmentos fotosintéticos y, como tales, captan la energía de la luz. También el fitol, por ser un componente de la clorofila, otro pigmento fotosintético.
- Constituyen estructuras biológicas, como las membranas celulares, en las que participan los fosfolípidos, esfingolípidos y colesterol.
2014
1.  Respecto al siguiente esquema: (a) Identifique la molécula que aparece en la imagen (1). (b) Indique sus elementos (3). (c) Cite dos funciones que puede realizar este tipo de moléculas y de un ejemplo de cada una (2). (d) Describa la estructura secundaria del DNA (3). (e) ¿En qué consiste la desnaturalización del DNA? ¿Qué factores la desencadenan? (1).
Respecto al siguiente esquema: (a) Identifique la molécula que aparece en la imagen (1). (b) Indique sus elementos (3). (c) Cite dos funciones que puede realizar este tipo de moléculas y de un ejemplo de cada una (2). (d) Describa la estructura secundaria del DNA (3). (e) ¿En qué consiste la desnaturalización del DNA? ¿Qué factores la desencadenan? (1).
(a) Desoxiadenosín monofosfato. Es un nucleótido.
(b)
- Una molécula de adenina.
- Una molécula de desoxirribosa.
- Una molécula de fosfato.
(c) Las funciones de los nucleótidos son:
- Formar parte de los ácidos nucleicos, el ADN o el ARN, al unirse a otras moléculas similares por enlaces fosfodiéster, llamados también nucleotídicos.
- Formar parte de la molécula de ATP, que es la molécula que transfiere energía química a cualquier clase de trabajo celular en todos los seres vivos.
- Formar la molécula de AMP cíclico, que actúa como mensajero intracelular (o "segundo mensajero") ante la llegada a la célula de hormonas no liposolubles (que no pueden atravesar la membrana celular).
- Formar parte de las coenzimas NADH, NADPH y FADH2, que transfieren electrones en reacciones de oxidación/reducción. En concreto, en su versión reducida (que es la representada), donan electrones a la cadena transportadora de electrones de la respiración celular (cadena respiratoria) y al ciclo de Calvin.
(d)
- El ADN celular está formado por 2 cadenas unidas en toda su longitud.
- Estas cadenas son antiparalelas, de modo que el extremo 3' de una está frente al extremo 5' de la otra.
- Las bases de los nucleótidos quedan hacia el interior de la molécula y los esqueletos desoxirribosa-fosfato, quedan en el exterior.
- La unión entre las 2 cadenas se establece por puentes de hidrógeno entre las bases.
- Las cadenas son complementarias, de modo que enfrente de una citosina siempre hay una guanina; y enfrente de una adenina siempre hay una timina.
- Entre C y G se forman 3 puentes de hidrógeno; entre A y T se forman 2.
- Los planos de las bases enfrentadas son paralelos entre sí y perpendiculares a los esqueletos desoxirribosa-fosfato.
- Las 2 cadenas están enrolladas helicoidalmente la una en torno a la otra.
- El enrollamiento es plectonémico: no se puede deshacer sin romper los puentes de hidrógeno que las unen.
- El enrollamiento es dextrógiro (en sentido horario en vista cenital).
- Por cada vuelta de hélice, que tiene una longitud de 3,4 nm, hay 10 pares de bases.
(e)
- Es la separación de las 2 hebras de una molécula de ADN celular al romperse los puentes de hidrógeno entre ellas.
- La elevación de la temperatura, la elevación de la concentración salina y cambios en el pH.
2.  Respecto a la figura representada: (a) Indique de qué tipo de biomolécula se trata y qué nombre recibe en función de su número de carbonos (b) Señale si se trata de una aldosa o una cetosa y explique por qué (c) Defina carbono asimétrico y señale los carbonos asimétricos que posee la molécula representada (d) Señale si se trata del isómero D o L y explique por qué (e) Un epímero de la molécula representada ¿en qué se diferenciaría de esta?
Respecto a la figura representada: (a) Indique de qué tipo de biomolécula se trata y qué nombre recibe en función de su número de carbonos (b) Señale si se trata de una aldosa o una cetosa y explique por qué (c) Defina carbono asimétrico y señale los carbonos asimétricos que posee la molécula representada (d) Señale si se trata del isómero D o L y explique por qué (e) Un epímero de la molécula representada ¿en qué se diferenciaría de esta?
(a) Es la fructosa. Una hexosa.
(b) Una cetosa, porque su grupo carbonilo no es terminal.
(c) Es un átomo de carbono que se une a 4 grupos de átomos diferentes. El 3, el 4 y el 5.
(d) Es un isómero D, porque el grupo hidroxilo del último carbono asimétrico (el 5) apunta a la derecha en la representación lineal de la molécula.
(e) Tendría cualquiera de los 3 carbonos asimétricos girados 180º lateralmente, pero no los 3, en cuyo caso no sería un epímero sino un enantiómero (la L-fructosa).
3.  Con respecto a los ácidos nucleicos: (a) Describa la estructura de los monómeros que forman el DNA (1). (b) Explique tres características de la estructura secundaria del DNA (3). (c) En relación a la figura adjunta indique a qué molécula corresponde y su función. Señale dos elementos destacados en esta molécula relacionados con su función (3). (d) Definir los siguientes términos: histonas, desnaturalización, cromatina (3).
Con respecto a los ácidos nucleicos: (a) Describa la estructura de los monómeros que forman el DNA (1). (b) Explique tres características de la estructura secundaria del DNA (3). (c) En relación a la figura adjunta indique a qué molécula corresponde y su función. Señale dos elementos destacados en esta molécula relacionados con su función (3). (d) Definir los siguientes términos: histonas, desnaturalización, cromatina (3).
(a) Se llaman desoxirribonucleótidos monofosfato, y están formados por una base nitrogenada orgánica (adenina, timina, citosina o guanina) unida por un enlace N-glucosídico al C1 de una molécula de desoxirribosa, a cuyo C5 va unido una molécula de fosfato.
(b)
- El ADN celular está formado por 2 cadenas unidas en toda su longitud.
- Estas cadenas son antiparalelas, de modo que el extremo 3' de una está frente al extremo 5' de la otra.
- Las bases de los nucleótidos quedan hacia el interior de la molécula y los esqueletos desoxirribosa-fosfato, quedan en el exterior.
- La unión entre las 2 cadenas se establece por puentes de hidrógeno entre las bases.
- Las cadenas son complementarias, de modo que enfrente de una citosina siempre hay una guanina; y enfrente de una adenina siempre hay una timina.
- Entre C y G se forman 3 puentes de hidrógeno; entre A y T se forman 2.
- Los planos de las bases enfrentadas son paralelos entre sí y perpendiculares a los esqueletos desoxirribosa-fosfato.
- Las 2 cadenas están enrolladas helicoidalmente la una en torno a la otra.
- El enrollamiento es plectonémico: no se puede deshacer sin romper los puentes de hidrógeno que las unen.
- El enrollamiento es dextrógiro (en sentido horario en vista cenital).
- Por cada vuelta de hélice, que tiene una longitud de 3,4 nm, hay 10 pares de bases.
(c)
- Es un ARN de transferencia.
- Su función es portar los aminoácidos a los ribosomas para permitir la traducción (biosíntesis de proteínas).
- El aminoácido se une por su extremo carboxilo al extremo 3' del ARNt.
- La unión, llamada "activación de los aminoácidos", es un proceso anabólico que consume energía y es catalizado por un aminoacil-ARNt sintasa específica.
- El aminoácido portado depende del triplete central del bucle central, que se llama anticodón.
- Para poder ceder su aminoácido al péptido en crecimiento, el anticodón ha de ser complementario del triplete de ARN mensajero (codón) que se encuentre en cada momento en el sitio P del ribosoma.
(d)
- Histonas: proteínas básicas de 5 clases (H1, H2A, H2B, H3 y H4) que, salvo en los espermatozoides, permiten la organización y el empaquetamiento del ADN del núcleo celular.
- Desnaturalización del ADN: es la separación de las 2 hebras de una molécula de ADN celular al romperse los puentes de hidrógeno entre ellas.
- Cromatina: complejo macromolecular formado por el ADN del núcleo celular asociado a proteínas tales como las histonas.
4. Con respecto a las proteínas: (a) Explique qué es la estereoisomería de los aminoácidos y que propiedad física aporta. ¿Qué determina que un aminoácido posea configuración D o L? (3). (b) Defina qué es la estructura secundaria de una proteína y ponga dos ejemplos (3). (c) ¿Cómo influye la temperatura en la actividad enzimática? (2) (d) ¿Cómo influye la presencia de un inhibidor reversible competitivo en la actividad de una enzima? (2)
(a)
- De cada aminoácido hay 2 formas. La forma "L", que es la propia de los aminoácidos de las proteínas, y es aquella que, en su representación plana, con la cadena lateral arriba y el carboxilo abajo, lleva el grupo amino a la izquierda. La forma "D" lleva el grupo amino a la derecha.
- La estereoisomería confiere actividad óptica, de modo que una disolución de aminoácidos "L" es levógira y desvía la luz polarizada hacia la izquierda, mientras que los aminoácidos "D" la desvían a la derecha.
(b)
- Es el primer nivel de organización espacial de una proteína y es debido a enlaces por puente de hidrógeno entre el grupo -C=O de un enlace peptídico y el grupo -NH de otro.
- Hoja plegada y α-hélice.
(c) Primeramente la favorece, ya que favorece el movimiento de las moléculas de sustrato y de enzima, y esto aumenta la probabilidad de que un sustrato enuentre el centro activo de un enzima. Rebasado un valor óptimo de temperarura, el incremento de esta induce la desnaturalización de la parte proteínica del enzima, el cual, al perder su forma, pierde su función.
(d) La reduce, ya que compite con el sustrato por el centro activo del enzima, reduciendo por tanto la probabilidad de que se forme el complejo enzima-sustrato.
2013
1. Recuerde lo que conoce sobre las biomoléculas y responda: (a) ¿Qué tipo de moléculas son las siguientes?: colágeno, actina, fosfatidilcolina, lactosa, ácido desoxirribonucleico, celulosa y colesterol (b) Respecto al colágeno y la celulosa ¿qué monómeros las forman y qué tipos de enlaces presentan cada una de estas moléculas? (c) En cuanto a la fosfatidilcolina, indique alguna de sus propiedades (d) ¿De qué sustancia es precursor el colesterol?
(a)
- Colágeno: una proteína fibrilar.
- Actina: una proteína globular.
- Fosfatidilcolina: un lípido del tipo de los fosfolípidos.
- Lactosa: un glúcido del tipo de los disacáridos.
- ADN: un ácido nucleico.
- Celulosa: un glúcido del tipo de los polisacáridos.
- Colesterol: un lípido insaponificable del tipo de los esteroides.
(b)
- Colágeno: lo forman aminoácidos unidos por enlaces peptídicos.
- Celulosa: la forman moléculas de ß-D-glucosa unidas por enlaces O-glucosídicos.
(c)
- Como fosfolípido es anfipático, con una parte polar (el aminoalcohol y el fosfato) y una parte apolar (los 2 ácidos grasos).
- Es constituyente de las membranas celulares.
(d)
- De las hormonas sexuales (andrógenos, estrógenos, progesterona).
- De las hormonas corticoides (cortisol, cortisona, aldosterona).
- De sales biliares.
- De la vitamina D3.
2. 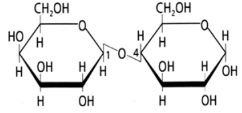 Observe la siguiente imagen y responda: (a) ¿Qué tipo de molécula es? (b) ¿Cuáles son los monómeros que la forman y qué tipo de enlace establecen? (c) ¿Presenta poder reductor o no? Razone la respuesta (d) Indique su función.
Observe la siguiente imagen y responda: (a) ¿Qué tipo de molécula es? (b) ¿Cuáles son los monómeros que la forman y qué tipo de enlace establecen? (c) ¿Presenta poder reductor o no? Razone la respuesta (d) Indique su función.
(a) Es la lactosa, un glúcido del tipo de los disacáridos.
(b)
- Una molécula de ß-galactosa y una de α-glucosa.
- Establecen un enlace O-glucosídico en ß(1→4).
(c) Sí, por que el carbonilo de la glucosa (su C1) no está participando en el enlace con la galactosa y está libre para donar electrones.
(d) Es el azúcar de la leche de los mamíferos. Tienen función, por tanto, nutritiva.
3. 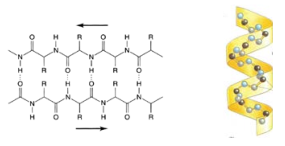 Con respecto a las proteínas: (a) Represente y explique la formación de un enlace peptídico (b) En relación a la figura adjunta, indique que estructuras son y sus características (c) ¿Qué tipos de enlaces estabilizan la estructura terciaria y cuaternaria de las proteínas? (d) Describa que son las heteroproteínas y poner dos ejemplos (e) Defina los siguientes términos: anfótero, desnaturalización, enzima, grupo prostético.
Con respecto a las proteínas: (a) Represente y explique la formación de un enlace peptídico (b) En relación a la figura adjunta, indique que estructuras son y sus características (c) ¿Qué tipos de enlaces estabilizan la estructura terciaria y cuaternaria de las proteínas? (d) Describa que son las heteroproteínas y poner dos ejemplos (e) Defina los siguientes términos: anfótero, desnaturalización, enzima, grupo prostético.
(a) Es un enlace covalente formado por condensación (pérdida de una molécula de agua) entre un grupo -NH2 y un grupo -COOH de 2 aminoácidos cercanos.

(b)
- Son la conformación ß y la α-hélice. Son las 2 variantes principales de la estructura secundaria de las proteínas. Ambas se forman por el establecimiento de puentes de H entre el grupo -NH de un enlace peptídico y el grupo -C=O de otro. Las cadenas laterales no intervienen.
- En el caso de la α-hélice, da lugar a un enrollamiento helicoidal de la cadena peptídica, con 3,6 aminoácidos por vuelta. Es un enrollamiento dextrógiro (en sentido horario) y con las cadenas laterales proyectadas hacia afuera.
- En el caso de la conformación ß, da lugar a la formación de una hoja plegada en zigzag con varias series de aminoácidos en paralelo, en la que las cadenas laterales quedan hacia arriba y hacia debajo de la hoja, alternativamente.
(c) Son enlaces entre cadenas laterales de los aminoácidos, de las siguientes clases, en orden de mayor a menor fortaleza:
- covalentes (puentes disulfuro entre 2 cisteínas);
- iónicos (entre aminoácidos ácidos y aminoácidos básicos);
- puentes de hidrógeno (entre aminoácidos polares);
- fuerzas de Van der Waals (entre aminoácidos apolares).
(d)
- Anfótero: sustancia capaz tanto de captar protones como de donarlos.
- Desnaturalización de una proteína: es la pérdida de la forma de la proteína, al romperse algunos de los enlaces que la mantienen y, con ello, de su función.
- Enzima: proteína capaz de catalizar de forma específica una determinada reacción química.
- Grupo prostético: es la parte no proteínica de una heteroproteína, cuando es permanente.
4.  Con referencia a los lípidos: (a) Explique la relación entre el punto de fusión de los ácidos grasos y el tamaño y grado de saturación de sus cadenas (3). (b) Defina que son los céridos y esteroides y señale un ejemplo de cada uno de ellos (2). (c) Indique que tipo de lípido es el de la figura, cuáles son sus componentes y sus tipos de enlace y señale una de sus funciones biológicas (5).
Con referencia a los lípidos: (a) Explique la relación entre el punto de fusión de los ácidos grasos y el tamaño y grado de saturación de sus cadenas (3). (b) Defina que son los céridos y esteroides y señale un ejemplo de cada uno de ellos (2). (c) Indique que tipo de lípido es el de la figura, cuáles son sus componentes y sus tipos de enlace y señale una de sus funciones biológicas (5).
(a) Cuando los ácidos grasos son de cadena más corta o cuando son insaturados y, por lo tanto, tienen codos en lugar de ser lineales, se forman menos puentes de hidrógeno entre unas moléculas y otras y de ahí su menor punto de fusión.
(b)
- Las ceras son lípidos saponificables formados por un ácido graso unido a un monoalcohol por un enlace éster. Un ejemplo son las que impermeabilizan el haz de las hojas de las plantas o la cutícula de los artrópodos.
- Los esteroides son lípidos insaponificables derivados del ciclopentano perhidro fenantreno. Un ejemplo es el colesterol.
(c)
- Es un esfingolípido; en concreto un fosfoesfingolípido o esfingomielina.
- Tiene 3 componentes:
- el alcohol esfingosina,
- un ácido graso (unido al grupo amino de la esfingosina por un enlace amida),
- una molécula polar, la fosforilcolina (unida a la esfingosina por un enlace éster).
- La fosforilcolina está, a su vez, formada por un grupo fosfato unido por un enlace éster a una molécula de colina.
- Es un constituyente de las membranas celulares. Y abunda en las vainas de mielina de los axones neuronales.
2012
1.  En relación a los glúcidos: (a) Indique qué molécula se muestra en la imagen y sus tipos de enlace (2). (b) Indique por qué la celulosa presenta alta resistencia mecánica (2). (c) Describa las diferencias entre proteoglucanos, glucoproteínas y peptidoglucanos (3). Pon un ejemplo de cada uno de ellos (3).
En relación a los glúcidos: (a) Indique qué molécula se muestra en la imagen y sus tipos de enlace (2). (b) Indique por qué la celulosa presenta alta resistencia mecánica (2). (c) Describa las diferencias entre proteoglucanos, glucoproteínas y peptidoglucanos (3). Pon un ejemplo de cada uno de ellos (3).
(a)
- Es la molécula de glucógeno o la de amilopectina.
- Es un polisacárido formado por moléculas de α-D-glucosa unidas por enlaces O-glucosídicos en 1→4 con ramificaciones en 1→6.
(b) Porque es un polisacárido formado por moléculas de ß-D-glucosa unidas por enlaces O-glucosídicos en 1→4. Los enlaces en ß(1→4) son muy estables y solo hidrolizables por celulasas que sólo poseen unos pocos microorganismos endosimbiontes de los mamíferos rumiantes y de los insectos xilófagos.
(c)
- Proteoglucanos son moléculas con una gran fracción glucídica y una pequeña parte de proteína. Ej: ácido hialuronico, sulfato de condroitina, heparina.
- Glucoproteínas son macromoléculas que contienen una pequeña fracción glucídica y una gran parte de proteína. Ej: mucinas, glucoproteínas de las membranas celulares.
- Peptidoglucano es un heteropolisacárido formado por unidades de N-acetil-glucosamina y ácido N-acetil-murámico unidos por pequeños oligopéptidos. Ej: la mureína de la pared celular de las bacterias.
2.  Con respeto a las proteínas: (a) Identifique el enlace de la figura y sus características (2). (b) Qué tipos de enlaces estabilizan la estructura secundaria y terciaria (4). (c) Defina el proceso de desnaturalización. ¿Qué tipo de enlaces no se ven afectados? (2). (d) Indique dos funciones proteicas (2).
Con respeto a las proteínas: (a) Identifique el enlace de la figura y sus características (2). (b) Qué tipos de enlaces estabilizan la estructura secundaria y terciaria (4). (c) Defina el proceso de desnaturalización. ¿Qué tipo de enlaces no se ven afectados? (2). (d) Indique dos funciones proteicas (2).
(a) Enlace peptídico. Es un enlace covalente, que se forma por condensación (pérdida de una molécula de agua), entre un grupo -NH2 y un grupo -COOH de 2 aminoácidos cercanos. Es un enlace fijo, sin libertad de rotación para los 2 átomos que lo forman.
(b)
- Secundaria. Se mantiene por puentes de hidrógeno entre el grupo -C=O de un enlace peptídico y el grupo -NH de otro.
- Terciaria: Se estabiliza por las siguientes clases de enlaces entre las cadenas laterales de los aminoácidos:
- covalentes (puentes disulfuro entre 2 cisteínas);
- iónicos (entre aminoácidos ácidos y aminoácidos básicos);
- puentes de hidrógeno (entre aminoácidos polares);
- fuerzas de Van der Waals (entre aminoácidos apolares).
(c)
- Es la pérdida de conformación, normalmente de forma irreversible, de una proteína. Comoquiera que la función de una proteína depende de su forma, la desnaturalización da lugar a proteínas no funcionales.
- No se ven afectados los enlaces peptídicos entre los aminoácidos que dan lugar a la estructura primaria de la proteína. Tampoco los enlaces covalentes (puentes disulfuro) de las estructuras terciaria y cuaternaria.
(d)
- Catalizar reacciones bioquímicas (las enzimas).
- Ayudar al empaquetamiento y organización del ADN celular (las histonas).
- Formar parte de las membranas celulares, donde actúan como canales de transporte de sustancias.
- Formar parte de las membranas celulares, donde actúan como moléculas de reconocimiento celular (receptores de hormonas, receptores de neurotransmisores, proteínas del Complejo Mayor de Histocompatibilidad).
- Constituir estructuras tales como la matriz intercelular de tejidos epiteliales (queratina) o conjuntivos (colágeno).
- Transportar sustancias por la sangre (hemoglobina, seroalbúmina, proteínas de los complejos LDL y HDL).
- Identificar antígenos, que son macromoléculas extrañas libres o de la superficie de virus o de células (los anticuerpos).
3. Sobre las enzimas: (a) ¿Qué función tienen en el metabolismo celular? (b) ¿Cuál es su mecanismo de acción? (c) ¿Qué significa que la actividad enzimática es específica y de qué depende? (d) ¿Crees que es importante la estructura terciaria de la enzima para su función? (e) ¿Qué son las coenzimas? ¿Cómo actúan? Razone las respuestas.
(a) Catalizan de forma específica todas y cada una de las reacciones químicas del metabolismo celular. De este modo, es la presencia de la enzima correspondiente, en la cantidad suficiente, en el lugar adecuado, y en el momento adecuado, la forma que tienen los organismos de inducir una reacción química. Por tanto, el modo que tiene el organismo de reguar el metabolismo, es el de expresar o no los genes que codifican para cada enzima, activando o desactivando así cada una de las reacciones metabólicas.
(b) El sustrato se une al enzima por las cadenas laterales de los aminoácidos del centro activo de este, del mismo modo que una llave encaja en una cerradura, o una mano en un guante. La unión se denomina complejo enzima-sustrato. Esta unión debilita los enlaces del sustrato, haciendo que alcanzar el estado de activación requiera mucha menos energía. De este modo se consigue que sean espontáneas reacciones que, de otro modo, apenas tendrían lugar.
(c)
- Significa que cada enzima solo pueden utilizar como sustrato bien a una molécula concreta (ATPasa), bien a una familia de moléculas con un enlace concreto (esterasas, nucleasas).
- Y significa que cada enzima solo puede catalizar un tipo de reacción y que cada tipo reacción es catalizada por un enzima diferente. (Una excepción es la RuBisCO, que normalmente fija CO2 a la ribulosa-1,5-difosfato, pero si hay mucho O2, es esta molécula la que combina a la ribulosa-1,5-difosfato, oxidándola; a esto se llama fotorrespiración).
(d)
La estructura terciaria es parte de la conformación (forma tridimensional) de una enzima. Y de esa conformación depende la capacidad de que una enzima se asocie a su sustrato. Por lo tanto si condiciona la funcionalidad de la enzima.
(e)
- Los coenzimas son los complementos orgánicos no permanentes de muchas enzimas.
- Los principales son las vitaminas.
- Los coenzimas son la parte del enzima que modifica los sustratos en productos.
4. 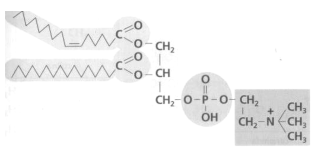 Observe la siguiente molécula: (a) Indique el tipo de biomolécula representada y señale su composición (5). (b) ¿Cómo se comporta frente al agua? (2). (c) ¿Qué función tienen estas moléculas en las células? (3).
Observe la siguiente molécula: (a) Indique el tipo de biomolécula representada y señale su composición (5). (b) ¿Cómo se comporta frente al agua? (2). (c) ¿Qué función tienen estas moléculas en las células? (3).
(a) Es un fosfolípido en el que se ve la glicerina a la que se unen 2 ácidos grasos y un grupo fosfato, y a este un aminoalcohol (la colina).
(b) Los fosfolípidos son siempre anfipáticos: tienen una parte apolar e hidrófoba (los ácidos grasos) y una parte polar e hidrófila (el fosfato y el aminoalcohol).
(c) Forman la bicapa lipídica de las membranas celulares, de modo que las colas apolares quedan en el interior de la bicapa y las cabezas polares quedan en el exterior.
2011
1. 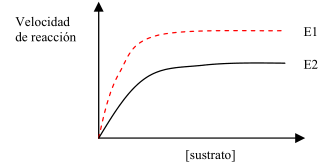 En relación con las enzimas: (a) Indicar tres características fundamentales (3). (b) Definir apoenzima, cofactor y coenzima. Poner dos ejemplos de cofactores (4). (c) En la siguiente figura que corresponde a dos enzimas distintas (E1 y E2) que actúan sobre el mismo sustrato: ¿cuál presenta mayor afinidad por el sustrato? Razonar la respuesta (3).
En relación con las enzimas: (a) Indicar tres características fundamentales (3). (b) Definir apoenzima, cofactor y coenzima. Poner dos ejemplos de cofactores (4). (c) En la siguiente figura que corresponde a dos enzimas distintas (E1 y E2) que actúan sobre el mismo sustrato: ¿cuál presenta mayor afinidad por el sustrato? Razonar la respuesta (3).
(a)
- Son específicas de sustrato: una enzima solo puede actuar sobre un único sustrato o una familia de sustratos químicamente similares.
- Son específicas de reacción: una enzima solo puede catalizar en su sustrato una única clase de reacción (salvo excepciones: la RuBisCO normalmente fija CO2 a la ribulosa-1,5-difosfato, pero si hay mucho O2, es esta molécula la que combina a la ribulosa-1,5-difosfato, oxidándola; a esto se llama fotorrespiración).
- No se consumen durante la reacción, ni se alteran tras ella, por lo que son reutilizables.
- Son desnaturalizables por una elevada temperatura o por variaciones del pH o de la salinidad, como cualquier otra proteína. Esto significa que pierden su conformación, normalmente de forma irreversible.
(b)
- Apoenzima: es la parte proteínica de una enzima.
- Cofactor: es la parte no proteínica de una enzima, cuando no es permanente. 2 ejemplos son los cofactores metálicos, como el Fe2+ o el Mg2+. O los cofactores orgánicos (coenzimas) como las vitaminas.
- Coenzima: es la parte no proteínica de una enzima cuando no es permanente y es orgánica.
(c) La enzima E1 tiene mayor afinidad por su sutrato, porque la fase ascendente de la curva tiene mayor pendiente, lo que significa que se alcanza antes la velocidad máxima (y también la semimáxima; es decir su constante de Michaelis-Menten es mayor).
2.  Dada la fórmula siguiente: (a) ¿De qué tipo de molécula se trata? (3). (b) ¿Qué tipo de enlace es el que está señalado con la flecha? (2). (c) ¿Posee capacidad reductora? Justificar la respuesta (2). (d) ¿De qué polímero forma parte? Señalar su función biológica (3).
Dada la fórmula siguiente: (a) ¿De qué tipo de molécula se trata? (3). (b) ¿Qué tipo de enlace es el que está señalado con la flecha? (2). (c) ¿Posee capacidad reductora? Justificar la respuesta (2). (d) ¿De qué polímero forma parte? Señalar su función biológica (3).
(a) Es la celobiosa, un glúcido del tipo de los disacáridos.
(b) Es un enlace O-glucosídico en ß(1→4).
(c) Sí, por que el carbonilo de la 2ª glucosa (su C1) no está participando en el enlace con la otra glucosa y está libre para donar electrones.
(d) Forma parte de la celulosa, que es uno de los polímeros esenciales de la pared celular de las plantas. Tiene por tanto función estructural, y por ello su enlace es difícilmente hidrolizable..
3. En relación a las proteínas: (a) Describe los diferentes niveles estructurales de las proteínas (6). (b) Explica por qué una alta temperatura, cambios en el pH, y otros cambios en el ambiente pueden afectar a la función de una proteína (4).
(a)
- Primario: es la secuencia de aminoácidos. Se mantiene por enlaces peptídicos entre ellos.
- Secundario: es un primer nivel de plegamiento. Se mantiene por puentes de hidrógeno entre el grupo -C=O de un enlace peptídico y el grupo -NH de otro. Las 2 modalidades principales con la α-hélice o la hoja plegada (conformación ß). Una misma proteína presenta regiones de ambas clases separadas por codos.
- Terciario: es un segundo nivel de plegamiento. Se mantiene por enlaces covalentes, iónicos, puentes de hidrógeno y fuerzas de Van der Waals, en todos los casos entre las cadenas laterales de los aminoácidos.
- Cuaternario: es la unión de 2 o más protómeros para formar una proteína funcional. Sólo se da en algunos casos, como el de la hemoglobina. Se mantiene por las mismas clases de enlaces que el nivel terciario.
- Los niveles secundario, terciario y cuaternario constituyen la conformación o forma tridimensional de la proteína, y a ella se debe su función.
(b)
- La elevada temperatura, al incrementar el estado de agitación de las moléculas, puede desencadenar la rotura de algunos de los enlaces que mantienen la conformación de la enzima, lo que normalmente es irreversible. Comoquiera que la función de una proteína depende de su forma, una subida de las temperaturas puede dar lugar a proteínas no funcionales.
- Las variaciones en el pH dan lugar a que cadenas laterales con carga negativa tengan que aceptar protones del medio si se hace muy ácido, o a que cadenas laterales con carga positiva tengan que donar protones al medio si se hace muy básico. En ambos casos las fuerzas electrostáctcas (iónicas y puentes de H) que contribuyen a su conformación (esructuras terciaria y cuaternaria, en concreto) van a deshacerse, lo que de nuevo hará que la proteína pierda su forma (y su función) de forma irreversible.
- Otro factor que puede dar lugar a la pérdida de la funcionalidad de la proteína es una elevación de la salinidad. Las sales van a secuestrar a las moléculas de agua que forman la capa de solvatación que se une a los restos polares de los aminoácidos de la proteína, haciendo que estas tiendan a agregarse entre sí, formando precipitados insolubles.
4. En relación al almidón y al glucógeno: (a) ¿Cuáles son sus principales semejanzas y diferencias a nivel estructural y funcional? (4). (b) ¿En qué organismos se encuentran este tipo de macromoléculas? (2). (c) Si los organismos tuvieran escasez de fósforo en su dieta o en el suelo (en el caso de las plantas), ¿tendrían problemas para sintetizar almidón o glucógeno?, ¿tendrían problemas para sintetizar alguna otra macromolécula? Razona tu respuesta (4).
(a)
- Los 2 son polímeros formados por cadenas de α-D-glucosa unidas por enlaces O-glucosídicos en 1→4. Además, el glucógeno y la amilopectina (uno de los 2 componentes del almidón) tienen ramificaciones en 1→6.
- Ambos se utilizan como moléculas de reserva energética, que se hidrolizan liberando molécula de glucosa que pasarán a ser degradadas oxidativamente en las mitocondrias mediante la respiración celular cuando se necesite energía para cualquier clase de trabajo celular.
(b) El almidón está presente en las plantas, mientras que el glucógeno está presente en animales y en hongos.
(c)
- No, porque el fósforo no forma parte de estas moléculas.
- Tendrían problemas para sintetizar ADN, ARN, fosfolípidos, esfingolípidos, fosfoproteínas…