Aminoácidos
- Las proteínas son polímeros de aminoácidos (polipéptidos) con una conformación espacial determinada y, eventualmente, unidos a otras moléculas o iones.
- Los aa' esenciales son los 9 de los 20 aminoácidos proteínicos que no podemos producir a partir de otros precursores, y que hemos de tomar con la dieta.
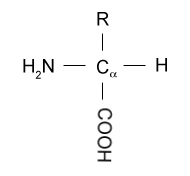
- Los aa' de las proteínas constan de un Cα central unido a un grupo amino, un grupo carboxilo, un H y una cadena lateral (R).
- Los aa' son anfóteros porque pueden aceptar o donar H+, según el pH del medio. Esto se debe a que el grupo amino puede aceptar H+ y el grupo carboxilo puede donar H+.
- En medio ácido los aa' aceptan H+ y quedan con carga positiva (cationes); en medio básico los aa' donan H+ y quedan con carga negativa (aniones).
- En el pH usual de los fluidos biológicos (próximo al neutro) ambos grupos suelen estar ionizados, por lo que los aa' son iones dobles.
- El punto isoeléctrico de un aa' es el valor intermedio del rango de pH en el que el aa' se encuentra en estado de ion doble.
- Como el punto isoeléctrico de los aa' es diferente, se pueden separar por electroforesis: una mezcla de ellos se somete a un campo eléctrico, a resultas de lo cual se desplazan hacia polos diferentes y a velocidades diferentes
- Como el Cα es asimétrico (salvo en la Gly), los aa' proteínicos tienen 2 estereoisómeros:
- La forma "L", que es la propia de los aminoácidos de las proteínas, es aquella que, en su representación plana, con la cadena lateral arriba y el carboxilo abajo, lleva el grupo amino a la izquierda. La forma "D" lleva el grupo amino a la derecha.
- La estereoisomería confiere actividad óptica, de modo que una disolución de aminoácidos "L" es levógira (desvía la luz polarizada hacia la izquierda), mientras que una de aminoácidos "D" es dextrógira.
- Clasificación según su cadena lateral:
- Neutros apolares: Gly, Ala, Cys...
- Cadena lateral neutra e hidrófoba.
- Neutros polares: Ser, Thr, Tyr, Asn, Gln.
- Cadena lateral neutra pero con grupos -OH o -NH2 que no se ionizan, pero que presentan una distribución asimétrica de la carga.
- Ácidos: Asp, Glu.
- Cadena lateral con un carboxilo que puede donar un H+.
- Básicos: Arg, Lys, His.
- Cadena lateral con un grupo amino que puede aceptar un H+.
- Neutros apolares: Gly, Ala, Cys...
- La cadena lateral es esencial de cara a los enlaces químicos que los aa' establecen entre ellos en las estructuras terciaria y cuaternaria:
- 2 Cys pueden establecer enlaces covalentes por puentes disulfuro.
- Los aa' ácidos pueden establecer enlaces iónicos con los aa' básicos.
- Los aa' polares pueden establecer puentes de H entre ellos.
- Todos los aa' pueden establecer uniones por fuerzas de Van de Waals.
Estructura
Primaria
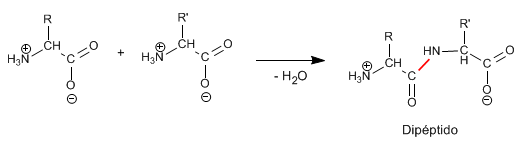
- Es la secuencia de aminoácidos unidos por enlaces peptídicos.
- Esa cadena de aminoácidos se denomina péptido:
- oligopéptido: 2 a 10 aa';
- polipéptido: Más de 10 aa'.
- Los péptidos siempre tienen un extremo amino libre (se debe colocar a la izquierda) y un extremo carboxilo libre.
- El enlace peptídico...
- se forma por condensación (pérdida de una molécula de agua) entre un grupo amino y un grupo carboxilo de 2 aminoácidos diferentes;
- es hidrolizable;
- es covalente;
- es de tipo amida;
- es un enlace fijo, sin libertad de rotación para los átomos que lo forman, ya que el N, el C y el O comparten electrones deslocalizados y están siempre en el mismo plano.
Secundaria
- Es el 1º nivel que contribuye a la conformación o estructura tridimensional de la proteína, de la que depende su función.
- Consiste en un plegamiento debido al establecimiento de puentes de H entre el grupo -N-H de un enlace peptídico y el grupo -C=O de otro, ya que el 'H' del 1º tiene carga parcial '+' y el 'O' del 2º tiene carga parcial '-'. Las cadenas laterales no intervienen.
- Hay 2 tipos, que aparecen en diferentes regiones de un mismo péptido, separadas por codos desorganizados:
- α-Hélice: da lugar a un enrollamiento helicoidal de la cadena peptídica, con 3,6 aminoácidos por vuelta. Es un enrollamiento dextrógiro (en sentido horario) y con las cadenas laterales proyectadas hacia afuera.
- Conformación ß: da lugar a la formación de una hoja plegada en zigzag, con varias series de aminoácidos en paralelo, en la que las cadenas laterales quedan hacia arriba y hacia debajo de la hoja, alternativamente.
Terciaria
- Es el 2º nivel que contribuye a la conformación o estructura tridimensional de la proteína, y el último en las proteínas que constan de un solo péptido.
- Consiste en un plegamiento debido al establecimiento de enlaces entre cadenas laterales enfrentadas, de las siguientes clases, en orden de mayor a menor fortaleza:
- covalentes (puentes disulfuro entre 2 cisteínas);
- iónicos (entre aminoácidos ácidos y aminoácidos básicos);
- puentes de hidrógeno (entre aminoácidos polares);
- fuerzas de Van der Waals (en cualquier otro caso).
- Este plegamiento resulta en una forma general de la proteína globular o fibrilar.
- La estructura primaria de la proteína es la responsable de su estructura terciaria, de modo que la sustitución de un aa' por otro podría impedir la formación de alguno de los enlaces anteriores o dar lugar a otros nuevos, alterando por completo su conformación y, con ello, su funcionalidad.
Cuaternaria
- Es el 3º nivel que contribuye a la conformación o estructura tridimensional de la proteína, y está presente solo en las proteínas que constan de más de un péptido.
- Consiste en la unión de 2 o más protómeros o subunidades proteínicas (péptidos con estructura terciaria) para formar una proteína funcional. Sólo se da en algunos casos (como la insulina, la hemoglobina o los anticuerpos).
- Se mantiene por las mismas clases de enlaces que la estructura terciaria.
Tipos
- Las proteínas globulares:
- Como la globina (de la hemoglobina), las histonas (de la cromatina), las inmunoglobulinas (o anticuerpos), el fibrinógeno (de la sangre) o la RuBisCO y todas las demás enzimas.
- Son solubles en fluidos biológicos porque ocultan sus cadenas laterales hidrófobas (las de los 10 aa' apolares) en su interior.
- Dan lugar a disoluciones coloidales, como la clara del huevo o el plasma sanguíneo.
- La elevación de la salinidad da lugar a que las sales secuestren a las moléculas de agua que forman la capa de solvatación que se une a los restos polares de los aminoácidos de la proteína, haciendo que estas tiendan a agregarse entre sí, formando precipitados insolubles.
- Las proteínas fibrilares, como la fibrina (formada a partir del fibrinógeno) o el colágeno. No son hidrosolubles porque han de aglomerarse con otras similares para poder ocultar sus cadenas laterales apolares de los medios acuosos y, al hacerlo, forman grandes conglomerados que precipitan.
Propiedades
- Su función depende de su conformación (de su forma). Cuando pierden su forma (desnaturalización) pierden su función, y suele ser de forma irreversible. Los motivos para esto pueden ser:
- La elevada temperatura, al incrementar el estado de agitación de las moléculas, puede desencadenar la rotura de algunos de los enlaces que mantienen la conformación de la enzima.
- Las variaciones en el pH dan lugar a que cadenas laterales con carga negativa tengan que aceptar protones del medio si se hace muy ácido, o a que cadenas laterales con carga positiva tengan que donar protones al medio si se hace muy básico. En ambos casos los enlaces iónicos que contribuyen a sus estructuras terciaria y cuaternaria van a deshacerse.
- Son muy específicas:
- Cada especie tiene proteínas que las demás especies no tienen.
- Cuando distintas especies tienen proteínas con la misma función, como la hemoglobina, estas tienen estructuras primarias algo diferentes (la humana y la porcina se diferencian en 1 aa'; la humana y la vacuna se diferencian en 3 aa'). Esto a veces permite establecer el grado de parentesco filogenético entre diferentes especies, sin necesidad de secuenciar y comparar sus genomas.
- Las hay específicas de cada individuo: en todas las células nucleadas de los mamíferos las proteínas del Complejo Mayor de Histocompatibilidad (CMH o MHC) de tipo I exponen fragmentos de proteínas propias, llamados autoantígenos, que permiten a los leucocitos reconocer a las células propias como propias, detectar a las extrañas y detectar a las propias que presentan neoantígenos propios de situaciones peligrosas para el organismo: células cancerosas, senescentes o infectadas por virus.
Funciones
- Constituyen estructuras como:
- el colágeno: por su resistencia al estiramiento forma parte de la sustancia intercelular de los tejidos conjuntivo, cartilaginoso y óseo;
- la elastina: por su elasticidad forma parte de las pleuras, las paredes de los vasos sanguíneos y la dermis;
- la reticulina: forma parte del tejido conjuntivo denso reticular que rellena y sirve de armazón a las vísceras;
- la queratina forma parte de la sustancia intercelular de tejidos epiteliales y de estructuras dérmicas (pelo, uñas, pezuñas, escamas, cuernos de bóvidos);
- las histonas ayudan al empaquetamiento y organización del ADN nuclear en la cromatina y, con ello, controlan la expresión de sus genes.
- la actina y la tubulina de los microtúbulos forman parte del citoesqueleto.
- Almacenan aminoácidos para el desarrollo de embriones o crías: ovoalbúmina (en la clara de los huevos), caseína (en la leche), gluten (en semillas de cereales)...
- Son precursoras de hormonas: insulina, glucagón, prolactina, ADH, GH...
- Forman parte de las membranas celulares, donde actúan como:
- canales de transporte de sustancias (grandes, iónicas, polares);
- moléculas receptoras de moléculas mensajeras (hormonas, neurotransmisores, citoquinas);
- moléculas receptoras de antígenos, como los nnticuerpos y los TCRs de os linfocitos; los antígenos son moléculas libres o de superficie propias de las células y los virus; es gracias a ellos que los leucocitos pueden identificar a microorganismos, células tumorales y células extrañas en general (como las de injertos de tejidos o de transplantes de órganos), de cara a su posterior eliminación.
- moléculas expositoras de autoantígenos, presentes en todas las células nucleadas de los mamíferos, y que permiten que estas sean reconocidas como propias por los leucocitos.
- Transportan sustancias por la sangre: hemoglobina (O2), seroalbúminas (ácidos grasos, metales), proteínas de los complejos LDL y HDL (grasas, colesterol).
- Participan en los movimientos de la célula: actina de los filamenos finos de los sarcómeros, miosina de los filamentos gruesos, tubulina de los microtúbulos.
- Enzimas: catalizan las reacciones bioquímicas.
Clasificación
Holoproteínas
Formadas solo por péptidos (uno o varios):
- Globulares: histonas, albúminas, enzimas...
- Fibrilares: colágeno, elastina, reticulina, miosina, queratina...
Heteroproteínas
Formadas por uno o varios péptidos unido(s) a una parte no peptídica (el grupo prostético):
- Glucoproteínas. Unidas a glúcidos. Anticuerpos, glucoproteínas de las membranas celulares.
- Lipoproteínas. Unidas a lípidos. HDL, LDL.
- Núcleoproteínas. Unidas a ADN. Los complejos CRISPR-Cas de las arqueas y las bacterias.
- Fosfoproteínas. Unidas al ácido ortofosfórico. Caseína de la leche, vitelina del huevo.
- Cromoproteínas. Unidas a una molécula coloreada, por tener dobles enlaces conjugados; esta puede ser una metalporfirina o no:
- Compuestos porfirínicos:
- hemoglobina (con Fe, en los glóbulos rojos);
- mioglobina (con Fe, en las células musculares);
- citocromos (con Fe, en las cadenas de transporte de electrones);
- peroxidasas y catalasas (con Fe, en los peroxisomas);
- clorofila (con Mg, en los cloroplastos).
- Compuestos no porfirínicos:
- hemocianina (en la sangre de algunos moluscos, crustáceos y arácnidos);
- rodopsina (en los bastones de la retina).
- Compuestos porfirínicos: